1月8日,中國國家藥監局藥品審評中心(CDE)官網公示,科倫博泰申報的1類新藥注射用博度曲妥珠單抗的第二項適應癥上市申請已獲得受理。這是一款靶向人類表皮生長因子受體 2(HER2)的抗體偶聯藥物(ADC)(此前稱A166)。根據科倫博泰今日發布的新聞稿介紹,本次該產品申報上市的適應癥為用于既往至少接受過一種抗HER2治療的HER2陽性不可切除或轉移性乳腺癌成人患者的治療。
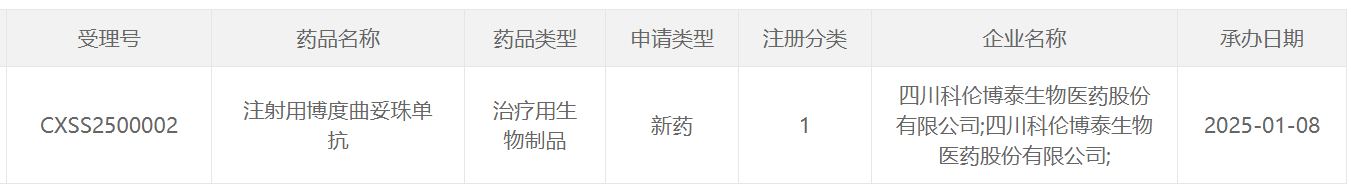
截圖來源:CDE官網
博度曲妥珠單抗是科倫博泰研發的創新靶向HER2的ADC,其通過穩定酶可裂解連接子將新型MMAF衍生物(高細胞毒性微管蛋白抑制劑Duo-5)與HER2單克隆抗體偶聯,藥物抗體比(DAR)為2。博度曲妥珠單抗特異性結合腫瘤細胞表面的HER2,并被腫瘤細胞內吞,在胞內釋放毒素分子Duo-5,Duo-5誘導腫瘤細胞周期阻滯在G2/M期,引起腫瘤細胞凋亡。博度曲妥珠單抗靶向結合HER2后也可抑制HER2介導的信號通路,具有抗體依賴細胞介導的細胞毒作用(ADCC)活性。
據科倫博泰官網介紹,根據主要分析結果,博度曲妥珠單抗已達到其針對3L+晚期HER2陽性乳腺癌的關鍵2期試驗的主要終點,并于2023年5月向NMPA遞交首個上市申請。
本次是該產品的第二項上市申請,適應癥為用于2L+晚期HER2陽性乳腺癌。根據科倫博泰新聞稿介紹,本次上市申請是基于一項多中心、隨機、開放、對照、3期KL166-III-06臨床研究,該研究評估了博度曲妥珠單抗單藥對比恩美曲妥珠單抗(T-DM1)在既往接受過曲妥珠單抗和紫杉類治療的HER2陽性不可切除或轉移性乳腺癌患者中的療效和安全性結果。在預設的期中分析中,與對照藥相比,博度曲妥珠單抗單藥在主要研究終點盲態獨立中心評估(BICR)評估的無進展生存期(PFS)方面具有顯著統計學意義和臨床意義的改善。
此前在2022年美國臨床腫瘤學會(ASCO)年會上,研究人員公布了博度曲妥珠單抗用于經過多線治療的HER2+乳腺癌患者的1期劑量擴展研究的更新數據,4.8mg/kg組客觀緩解率(ORR)達73.9%,中位無進展生存期(PFS)達12.3個月,不良反應可控,博度曲妥珠單抗療效和安全性再次得到驗證。
除了上述適應癥,科倫博泰還在中國開展了A166針對其他晚期HER2陽性實體瘤的1b期臨床試驗。希望這款ADC新藥后續注冊和研究進程順利,早日為患者帶來新的治療選擇。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..