1. 用于治療潰瘍性結腸炎(UC)的口服抗體療法達到1b期臨床試驗的主要目標,并在多個臨床終點方面展現良好的活性。
2. 中樞神經系統(CNS)滲透性TYK2抑制劑A-005取得積極的1期臨床試驗結果,具有良好的耐受性,并能穿越血腦屏障。
3. 用于治療慢性乙型肝炎病毒(HBV)感染的下一代衣殼組裝調節劑(CAM)ABI-4334在1b期臨床試驗中展現強力的抗病毒活性,28天使患者血漿HBV DNA平均降低了2.9 log IU/mL。
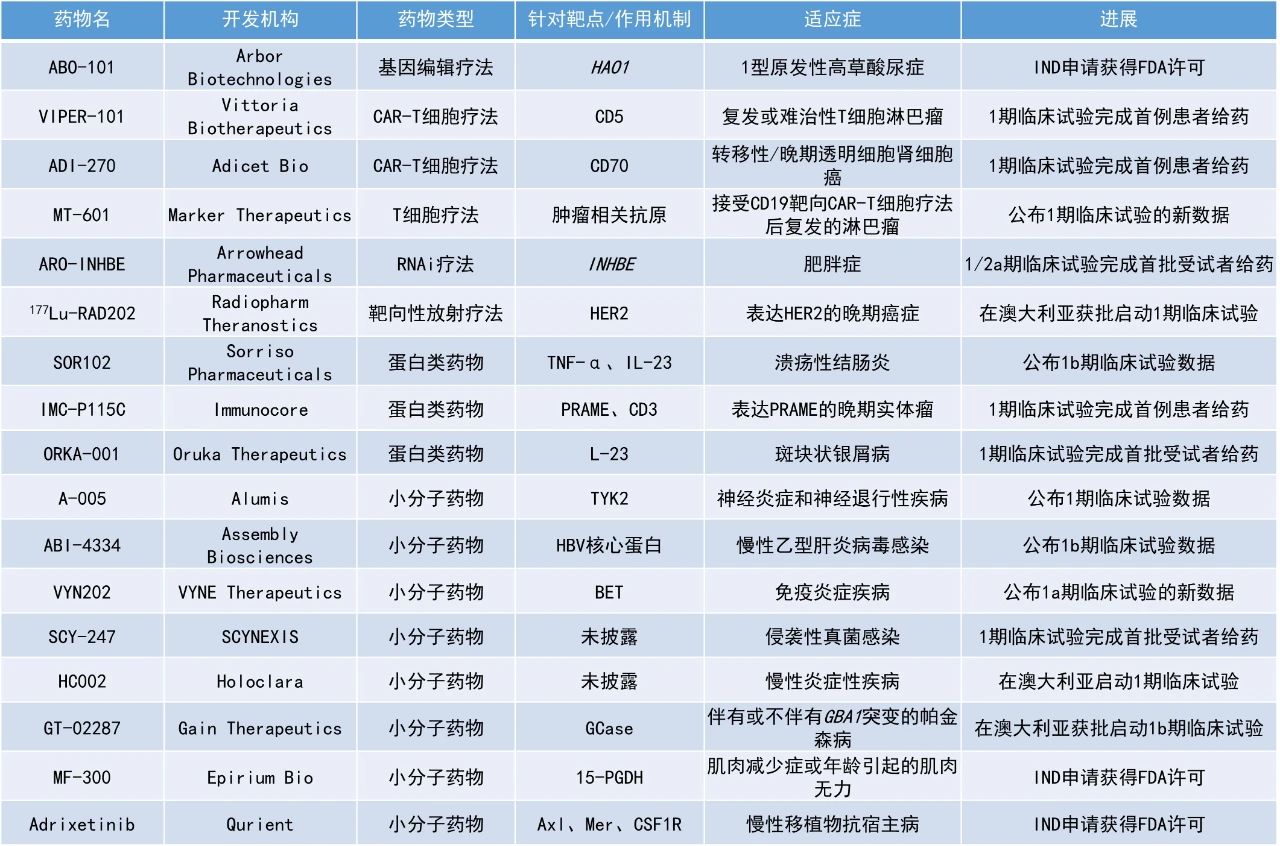
Sorriso Pharmaceuticals公司公布了其針對潰瘍性結腸炎患者的口服TNFα和IL-23雙效生物制品SOR102的積極1b期臨床試驗結果。SOR102通過在發炎組織內部提供局部組合療法,同時盡量減少全身暴露,有望通過同時阻斷炎癥性腸病的不同機制來提高療效。此次公布的結果顯示,該研究達到了主要目標,顯示出良好的安全性和耐受性。此外,關鍵的探索性療效終點結果顯示,SOR102在多個臨床終點方面具有良好的活性。具體表現為,在完成研究的患者中,高劑量SOR102組患者在多個臨床終點上與安慰劑組患者相比達到了統計學上的顯著差異,包括Mayo評分臨床緩解、改良Mayo評分臨床緩解、癥狀緩解,以及Mayo評分、改良Mayo評分和UC-100評分與基線相比的平均下降值。新聞稿指出,該研究結果首次成功證明了口服抗體能夠產生臨床療效。Alumis公司公布了其強效、選擇性、CNS滲透性TYK2抑制劑A-005的1期臨床試驗的積極數據。新聞稿指出,A-005是首個公開的TYK2變構抑制劑。該候選療法旨在實現最大的TYK2抑制效果,并能夠穿越血腦屏障,在CNS內部和外周進行局部治療,支持其在多個TYK2介導適應癥中的潛力。該候選療法正在開發用于治療神經炎癥和神經退行性疾病,如多發性硬化(MS)和帕金森病。此次公布的結果顯示,A-005具有良好的耐受性,并能穿越血腦屏障。此外,A-005在CNS和外周實現了最大的TYK2抑制,并具有良好的藥代動力學特征。基于這些數據,該公司預計在2025年下半年開始,在MS患者中進行2期臨床試驗。Assembly Biosciences公司公布了其在研下一代衣殼組裝調節劑ABI-4334用于治療慢性HBV感染患者的1b期臨床試驗數據。此次公布的結果顯示,在首個150 mg劑量組中,ABI-4334顯示出很強的抗病毒活性,在28天的治療中,血漿HBV DNA平均降低了2.9 log IU/mL。此外,ABI-4334耐受性良好,具有良好的安全性,半衰期支持每日一次口服給藥。VYNE Therapeutics公司公布了其口服小分子BET抑制劑VYN202的積極1a期臨床試驗結果。新聞稿指出,相對于BD1,VYN202對BD2具有潛在“class-leading”的選擇性和效力。此次公布的結果顯示,VYN202有潛力成為一種新型的、每日一次的口服藥物,用于治療廣泛的免疫介導疾病。與1a期單劑量遞增結果一致,VYN202展現了良好的安全性和耐受性特征,沒有出現與早期選擇性較低的BET抑制劑相關的藥物相關不良事件。此外,VYN202在體外刺激試驗中展現了強大的藥理活性,包括靶點結合和顯著抑制與幾種免疫介導疾病相關的炎癥生物標志物的證據。Epirium Bio公司宣布,美國FDA已批準其潛在“first-in-class”的口服15-羥基前列腺素脫氫酶(15-PGDH)抑制劑MF-300的IND申請,用于治療肌肉減少癥或年齡引起的肌無力。15-PGDH是一種能將前列腺素E2(PGE2)轉化為非活性代謝物的酶。MF-300旨在可逆地結合到15-PGDH的PGE2結合位點上,阻止該酶轉化PGE2。在生化試驗中,MF-300能夠抑制15-PGDH的活性。在臨床前的細胞和動物研究中,MF-300可穩定和增加PGE2的水平。2024年12月,該公司已開始為MF-300的1期劑量遞增研究招募患者。Qurient宣布,美國FDA已批準其免疫腫瘤藥物adrixetinib的IND申請,可開展針對慢性移植物抗宿主病(cGVHD)的1b期臨床試驗。Adrixetinib是一種針對Axl、Mer和CSF1R的選擇性三重激酶抑制劑。這種藥物能增強機體的免疫防御能力,提高癌細胞對治療的敏感性。新聞稿指出,adrixetinib能夠通過抑制CSF1R治療cGVHD,并通過抑制Axl/Mer治療白血病,這種雙重作用機制有望為同時治療這兩種疾病提供潛在的益處。
