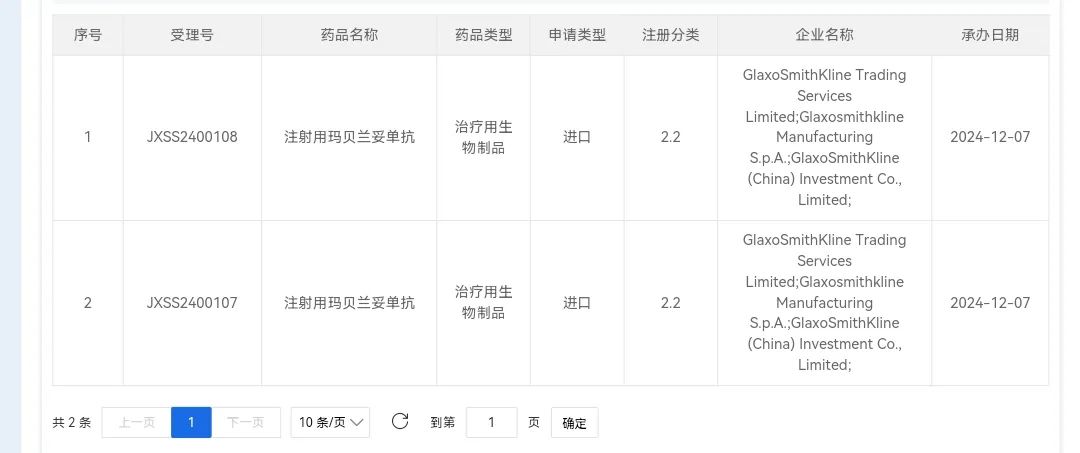
12 月 07 日,CDE 官網(wǎng)顯示,葛蘭素史克的注射用瑪貝蘭妥單抗(Belantamab mafodotin )上市申請獲得受理。此前,該申請已被納入優(yōu)先審評,適應(yīng)癥為與硼替佐米+地塞米松聯(lián)合治療既往接受過至少一種治療的多發(fā)性骨髓瘤(MM)成年患者。
Belantamab mafodotin 是一款靶向 BCMA 的抗體偶聯(lián)藥物(ADC)。2020 年 8 月,基于關(guān)鍵性 Ⅱ 期臨床 DREAMM-2 研究的結(jié)果,該藥先是獲得 FDA 加速批準(zhǔn)上市,而后獲得 EMA 附條件批準(zhǔn)上市,作為單藥療法治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤成人患者,成為了全球首個獲批上市的 BCMA ADC。
不過,F(xiàn)DA 的加速批準(zhǔn)和 EMA 的附條件批準(zhǔn)都是有「條件」的,Belantamab mafodotin 的結(jié)果需要在后續(xù) Ⅲ 期臨床試驗 DREAMM-3 中得到進(jìn)一步證實才可以。DREAMM-3 試驗旨在評估Belantamab mafodotin 單藥與泊馬度胺聯(lián)合低劑量地塞米松治療復(fù)發(fā)/難治 MM 患者的療效和安全性,主要終點是 PFS,次要終點包括總生存期、安全性、ORR、反應(yīng)持續(xù)時間和微小殘留病評估。
然而,2022 年 11 月,GSK 宣布 DREAMM-3 研究未達(dá)到其無進(jìn)展生存期 (PFS) 的主要終點。基于此,GSK 主動撤回了 Belantamab mafodoti 在美國的上市申請。隨后,歐盟 EMA 也撤回了 Belantamab mafodoti 的上市許可。
雖然在日本和歐盟的上市不順利,但研究顯示 Belantamab mafodoti 還可以使部分多發(fā)性骨髓瘤患者受益。
例如,在 Ⅲ 期臨床試驗 DREAMM-7 中,研究人員評估了 Belantamab mafodotin +硼替佐米+地塞米松與達(dá)雷妥尤單抗 +硼替佐米+地塞米松 聯(lián)合治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤患者的療效和安全性,這些患者之前至少接受過一線治療,主要終點是 PFS。
2024 年 ASCO 年會上公布的數(shù)據(jù)顯示,在意向治療人群 (ITT) 中:
中位 PFS 方面,Belantamab mafodotin 組為 36.6 個月,顯著高于達(dá)雷妥尤單抗組的 13.4 個月;
與標(biāo)準(zhǔn)治療達(dá)雷妥尤單抗組合相比,將患者病情進(jìn)展或死亡風(fēng)險降低了 59%;
ORR 方面,Belantamab mafodotin 組為 82.7%(vs 達(dá)雷妥尤單抗組 71.3%);
Belantamab mafodotin 組治療在總體生存率方面呈現(xiàn)出強(qiáng)勁、具有臨床意義的趨勢,死亡風(fēng)險降低了 43%。
此外,在 III 期臨床試驗 DREAMM-8 中,研究人員又評估了 Belantamab mafodotin + 泊馬度胺+地塞米松聯(lián)合治療與硼替佐米+ 泊馬度胺+地塞米松聯(lián)合治療復(fù)發(fā)/難治 MM 的療效和安全性,這些患者之前曾接受過至少一線治療。
與 DREAMM-7 試驗中研究的患者群體相比,DREAMM-8 中的患者接受的預(yù)先治療更多,因為所有患者都曾接受過來那度胺治療,75% 患者對來那度胺有耐藥性,25% 患者曾接受過達(dá)雷妥尤單抗治療,其中大多數(shù)對達(dá)雷妥尤單抗有耐藥性。
今年 ASCO 上公布的 DREAMM-8 研究數(shù)據(jù)顯示:
在主要終點 mPFS 方面,試驗組尚未達(dá)到,對照組為 12.7 個月;
次要終點方面,試驗組 ORR 為 77%(vs 對照組 72%),CR 為 40%(vs 對照組 16%),mDoR 尚未達(dá)到(vs 對照組 17.5 個月),12 個月 PFS 率為 71%(vs 對照組 51%),OS 隨訪仍在進(jìn)行中。
DREAMM-8 研究認(rèn)為,在復(fù)發(fā)/難治 MM 中,Belantamab mafodotin 組具有統(tǒng)計學(xué)意義和臨床意義的 PFS 優(yōu)勢,而且還帶來了更深層次和更持久的反應(yīng),顯示出良好的 OS 趨勢,并且具有可控的安全性。
基于 DREAMM-7 和 DREAMM-8 的積極研究數(shù)據(jù),今年 7 月和 9 月,歐洲 EMA 和日本厚生勞動省 (MHLW) 已分別接受了 Belantamab mafodotin 與硼替佐米+地塞米松 (BorDex) 或泊馬度胺+地塞米松 (PomDex) 聯(lián)合治療復(fù)發(fā)或難治性多發(fā)性骨髓瘤的上市申請。
本次在中國申報上市并被納入優(yōu)先審評意味著,其將有望在國內(nèi)加速獲批,早日惠及國內(nèi)患者。
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會組織召開
2025版《中國藥典》將于2025年10月..關(guān)于舉辦四川省藥品生產(chǎn)企業(yè)擬新任質(zhì)量
各相關(guān)企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質(zhì)量管理協(xié)會召開第七
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會第七..“兩新聯(lián)萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學(xué)習(xí)傳達(dá)中央八項規(guī)定精神專題會議
2025年4月22日,協(xié)會黨支部組織召..關(guān)于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..