根據 Insight 數據庫,在剛結束的 11 月,總計有 22 款新藥向 CDE 遞交了上市申請(含新適應癥)。其中,有 8 款為抗腫瘤新藥,包括 5 個新藥的首次 NDA 和 3 款新藥的新適應癥 NDA。以下將節(jié)選 4 個首次申報 NDA 的抗腫瘤新藥介紹,僅供參閱。
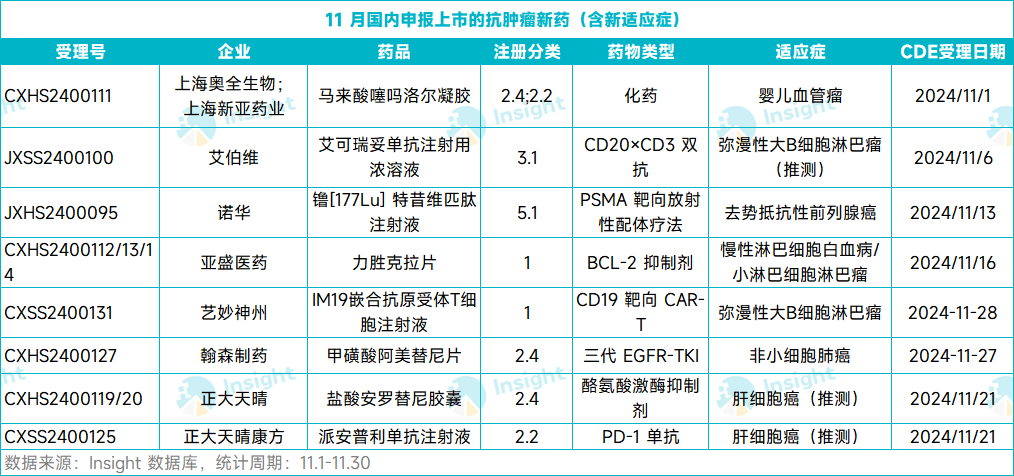
奧全生物:噻嗎洛爾凝膠
首個報上市的嬰幼兒血管瘤外用制劑
11 月 1 日,奧全生物的馬來酸噻嗎洛爾凝膠 NDA 獲 CDE 受理,并被納入優(yōu)先審評,用于治療增生期淺表型嬰幼兒血管瘤。根據奧全生物新聞稿,這是全球首個申請上市的嬰幼兒血管瘤外用制劑。
嬰幼兒血管瘤是一種兒童時期常見的良性腫瘤,且女性多于男性,其中約 60% 發(fā)生于頭頸部。目前,全球尚無治療嬰幼兒血管瘤的外用藥物獲批上市。
奧全的噻嗎洛爾凝膠已在國內完成兩項針對嬰幼兒血管瘤的臨床研究:
一項為Ⅰ期臨床(CTR20181638),旨在健康中國成年受試者中評估單次、多次涂抹的馬來酸噻嗎洛爾凝膠后的安全性、耐受性;
一項為隨機、雙盲、安慰劑對照的 Ⅱ 期研究(CTR20200156),旨在評估馬來酸噻嗎洛爾凝膠治療增生期淺表型嬰幼兒血管瘤的有效性和安全性。
諾華:镥 [177Lu] 特昔維匹肽
PSMA 靶向放射性配體療法
11 月 13 日,諾華的镥 [177Lu] 特昔維匹肽上市申請獲 CDE 受理。該申請已被納入優(yōu)先審評,適用于治療前列腺特異性膜抗原(PSMA)陽性轉移性去勢抵抗性前列腺癌(mCRPC) 、已接受雄激素受體通路抑制和紫杉類化療的成年患者。
镥 [177Lu] 特昔維匹肽(177Lu-PSMA-617)是一款 PSMA 靶向放射性配體療法,于 2022 年 3 月在美國獲批上市(海外商品名 Pluvicto),是 FDA 批準的首個針對去勢抵抗性前列腺癌患者的靶向放射性配體療法。
關鍵性 III 期臨床試驗 VISION 結果顯示:與標準治療(SoC)相比,Pluvicto+SoC 可顯著延長影像學無進展生存期(rPFS,8.7 vs 3.4 個月)和總生存期(OS,15.3 vs 11.3 個月)。而且,與 SoC 相比,Pluvicto+SoC 可降低患者的死亡風險,以及患者出現放射學疾病進展或死亡的風險。
Pluvicto 的市場表現也非常有潛力。上市后第二年(2023 年),它的銷售額就達到了 9.8 億美元,同比增速高達 263%。諾華最新三季報顯示,2024 年前三季度,它的銷售額已達 10.41 億美元,成為了諾華的又一個重磅炸彈藥物。
亞盛醫(yī)藥:力勝克拉
首個國產 BCL-2 抑制劑
11 月 16 日,亞盛醫(yī)藥力勝克拉片(APG-2575 片)上市申請獲得 CDE 受理。該申請已被納入優(yōu)先審評,用于治療難治或復發(fā)性慢性淋巴細胞白血病/小淋巴細胞淋巴瘤(CLL/SLL)患者。
Insight 數據庫顯示,BCL-2 抑制劑賽道,國內目前僅有艾伯維的維奈克拉獲批上市,用于治療急性髓系白血病(AML)。力勝克拉是首個報上市的國產 BCL-2 抑制劑。
23 年 ASH 年會上,亞盛公布了力勝克拉對接受過大量治療的 CLL 患者的最新療效和安全性結果。結果顯示:
CLL 患者的 ORR 為 73.3%(33/45),CR/CRi 率為 24.4%(11/45),且 CR/CRi 率隨劑量增加呈上升趨勢。
外周血 MRD 檢測患者中,38.9%(7/18)達到 MRD 陰性狀態(tài)。通過骨髓 MRD 檢測患者中,66.7%(4/6)為 MRD 陰性。
首次緩解中位時間為 2.07 個月,中位 PFS 為 18.53 個月,30 個月 OS 率為 86.3%,意味著力勝克拉具有為 CLL 患者帶來長期生存獲益的潛力。
此外,APG-2575 也在 R/R CLL 患者中表現出了良好的安全性和耐受性。
BCL-2 是血液腫瘤領域的熱門靶點。除了維奈克拉和力勝克拉之外,國內還有十多款在研項目進入臨床階段,競爭最激烈的適應癥領域是 CLL/SLL、AML。
其中,在 CLL/SLL 適應癥領域,國內尚無 BCL-2 抑制劑獲批,亞盛的力勝克拉是首個提交該適應癥 NDA 的 BCL-2 抑制劑。這意味著,國產 BCL-2 抑制劑有望趕超外企,搶先在國內拿下 CLL/SLL 適應癥。目前,亞盛還在探索力勝克拉在 CLL/SLL 一線治療中的潛力。
藝妙神州:IM19 CAR-T 細胞注射液
CD19 靶向 CAR-T
11 月 28 日,藝妙神州的 IM19 CAR-T 細胞注射液(IM19)上市申請獲 CDE 受理,用于治療復發(fā)或難治彌漫大 B 細胞淋巴瘤(r/r DLBCL)。
IM19 CAR-T 細胞注射液是藝妙神州自主研發(fā)的首款血液腫瘤 CAR-T 細胞候選藥物,已獲得 NMPA 批準開展針對 3 個適應癥的臨床,包括復發(fā)/難治性 DLBCL、急性 B 淋巴細胞白血病(r/r B-ALL)、套細胞淋巴瘤(r/r MCL)。
本次上市申請是基于一項在中國進行的開放標簽、單臂、多中心的確證性臨床試驗。該研究結果顯示,IM19 治療 r/r DLBCL 患者具有良好的療效和安全性。今年 8 月,藝妙神州已與華東醫(yī)藥就 IM19 達成在中國大陸地區(qū)的商業(yè)化授權合作。
Insight 數據庫顯示,國內目前已有 6 款 CAR-T 獲批上市,同時還有 3 款 CAR-T 正在上市申請中。藝妙神州的 IM19 是國內第 9 款報上市的 CAR-T。
上一篇:3 款國產新藥獲 CDE 擬突破性治療,分別為.. 下一篇:藥監(jiān)動態(tài) | 第十八屆中國制藥工程大會在南..
四川省醫(yī)藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業(yè)擬新任質量
各相關企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質量管理協會召開第七
四川省醫(yī)藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規(guī)定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..