1. RNAi療法nucresiran治療轉甲狀腺素蛋白(ATTR)介導淀粉樣變性患者的早期臨床試驗結果亮眼,單次給藥后第15天,患者平均血清轉甲狀腺素蛋白(TTR)水平降低超過90%,并維持至試驗第6個月。
2. 抗體偶聯藥物PYX-201在一項1期臨床試驗中,在頭頸部鱗狀細胞癌患者中的疾病控制率(DCR)達100%,客觀緩解率(ORR)達50%。
3. 用于治療代謝功能障礙相關性脂肪性肝炎(MASH)和肥胖癥的胰高血糖素樣肽-1(GLP-1)/胰高血糖素雙重受體激動劑pemvidutide在一項早期臨床試驗中展現積極療效,患者用藥12周后肝臟脂肪含量(LFC)相對基線減少68.5%。
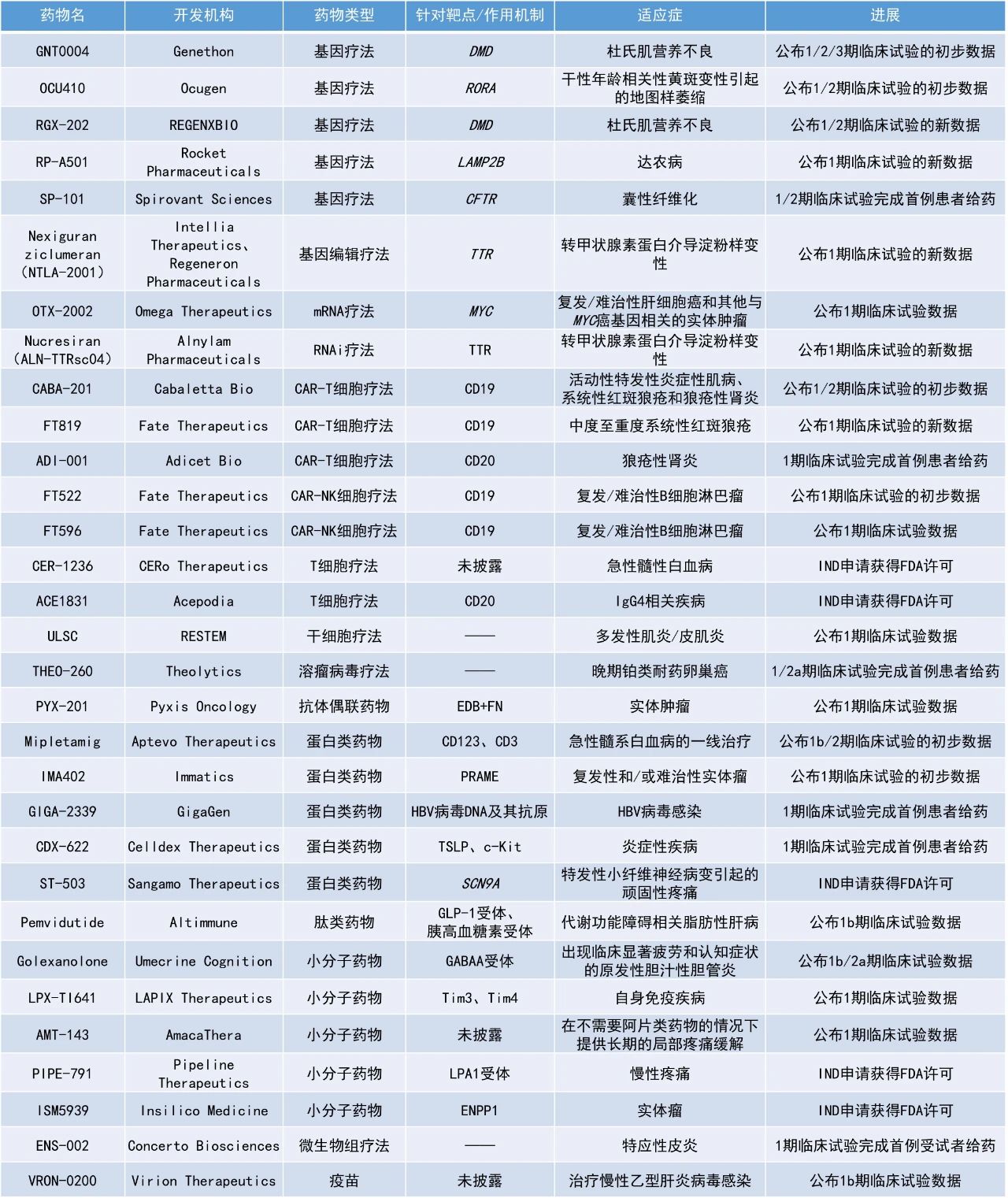
Nucresiran(ALN-TTRsc04):公布1期臨床試驗的新數據Alnylam Pharmaceuticals公司公布了其下一代RNAi療法nucresiran(曾用名ALN-TTRsc04)用于治療轉甲狀腺素蛋白介導淀粉樣變性患者的1期臨床研究的最新數據。Nucresiran通過Alnylam專有IKARIA平臺所開發,旨在迅速降低突變型和野生型TTR的水平,從根本上治療ATTR淀粉樣變性。Nucresiran具有實現更深層次和更持久TTR快速降低的潛力,從而能夠減少用藥頻率。此次公布的顯示,單次給予300 mg或更高劑量的nucresiran,可在第15天實現患者平均血清TTR水平快速降低超過90%,且這一效果持續至試驗第6個月。數據表明,nucresiran具有每半年或每年進行一次皮下注射的潛力。Alnylam計劃在2025年第一季度公布3期臨床開發方案。Pyxis Oncology公司公布了其候選抗體偶聯藥物PYX-201治療多種類型實體瘤的1期劑量遞增研究的初步積極數據。PYX-201以微管抑制劑(優化的auristatin)作為有效載荷,能獨特地靶向腫瘤細胞外基質(ECM)中的一種非細胞結構成分——纖連蛋白B結構域(Extradomain-B Fibronectin,EDB+FN)。 截至2024年10月4日的數據,在6例療效可評估的頭頸部鱗狀細胞癌患者中,觀察到確認的ORR為50%,包括1例確認的完全緩解(CR)和2例確認的部分緩解(PR),DCR為100%。在所有6種研究者感興趣的實體瘤(頭頸部鱗狀細胞癌、卵巢癌、非小細胞肺癌、HR+/HER2-乳腺癌、三陰性乳腺癌和肉瘤)患者(n=31)中,ORR為26%,研究人員還觀察到劑量依賴性的緩解。此外,PYX-201通常耐受性良好,具有良好的安全性。Altimmune公司公布了pemvidutide治療代謝功能障礙相關性脂肪性肝病(MASLD)的1b期試驗的最新數據。Pemvidutide是一種GLP-1/胰高血糖素雙重受體激動劑,目前正在開發用于治療MASH和肥胖癥。該研究中,94名超重或肥胖且LFC≥10%的受試者按1:1:1:1的比例被分配接受pemvidutide(1.2 mg、1.8 mg和2.4 mg)或安慰劑,每周一次皮下注射,持續12周。數據顯示,患者血漿中與心血管不良后果相關的多類炎癥脂質有所減少。患者接受pemvidutide治療12周后,LFC相對基線減少了68.5%,總膽固醇和甘油三酯分別最多降低了12.2%和44.6%。研究結果支持pemvidutide對MASH合并癥的潛在益處,包括動脈粥樣硬化、心臟病和代謝綜合征。Immatics公司公布了其下一代半衰期延長的T細胞受體(TCR)雙特異性分子IMA402的1期劑量遞增試驗數據。IMA402靶向由HLA-A*02呈遞的黑色素瘤抗原PRAME。PRAME是一種在各種實體瘤中經常表達的蛋白質,因此IMA402具潛力治療廣泛的癌癥患者群體。截至2024年11月6日的數據,IMA402在接受治療的33例患者中表現出良好的耐受性。最常見的治療相關不良事件多為輕度至中度細胞因子釋放綜合征(CRS)和短暫的淋巴細胞減少癥。早期藥代動力學數據表明,IMA402的中位半衰期約為7天,有望支持每兩周一次的給藥方案。9例PRAME檢測陽性或未接受PRAME檢測的患者中有7例實現了靶病灶縮小,1例皮膚黑色素瘤患者獲得了確認的PR,靶病灶已縮小40.2%。Mipletamig:公布1b/2期臨床試驗的初步數據Aptevo Therapeutics公司公布了其正在進行的1b/2期臨床試驗RAINIER中首例患者的治療情況。該研究針對18歲及以上新確診為急性髓系白血病且不符合強化誘導化療條件的成人患者,旨在評估使用mipletamig聯用標準治療維奈托克和阿扎胞苷作為一線療法的效果。APVO436是一種創新雙特異性重組蛋白,它像兩個單克隆抗體連接在一起,可以同時靶向腫瘤細胞表面的CD123和T淋巴細胞表面的CD3,從而將宿主免疫系統的T細胞重定向到患者的腫瘤細胞上,以快速和完全摧毀表面表達CD123的腫瘤細胞。此次公布的結果顯示,首例患者在治療的前30天內白血病細胞減少了90%,延續了先前研究中觀察到的總體療效趨勢。Sangamo Therapeutics公司宣布,美國FDA批準了其在研表觀遺傳調節劑ST-503的IND申請,用于治療特發性小纖維神經病變引起的頑固性疼痛(iSFN),這是一種慢性神經病理性疼痛。大量的證據表明,鈉通道在介導神經病理性疼痛的病理生理過程中起著重要作用。開發特異性靶向Nav1.7鈉通道的小分子藥物具有挑戰性,因為不同鈉通道之間的結構相似性很高,難以實現選擇性并避免脫靶效應。ST-503以腺相關病毒(AAV)為載體,攜帶工程化的鋅指抑制子(ZFR),能夠特異性地靶向編碼Nav1.7鈉通道的人類基因SCN9A,該基因在疼痛信號傳導中起關鍵作用。在動物模型中,通過直接靶向SCN9A基因,ST-503被證明可以特異性地減少感覺神經元中Nav1.7鈉通道的表達,并在單次鞘內給藥后顯著減少對疼痛的高敏感性。臨床前研究表明,ST-503在非人靈長類動物中具有良好的耐受性,觀察到顯著的Nav1.7減少且沒有脫靶效應,這顯示了ST-503治療慢性神經病理性疼痛的潛力。Sangamo公司正在準備進行1/2期臨床研究,以評估單次劑量ST-503的安全性、耐受性和初步療效,該藥物將通過鞘內給藥的方式給予iSFN患者,并計劃于2025年中期開始患者招募。Concerto Biosciences公司宣布,其用于治療特應性皮炎的微生物組療法ENS-002的1期臨床試驗已完成首例受試者給藥。ENS-002是該公司利用一種名為kChip的強大篩選技術,從超過600萬個皮膚微生物群落中發現的可緩解濕疹的細菌組合,該組合中包含三種菌株,能夠抑制皮膚炎癥的關鍵驅動因素金黃色葡萄球菌(S.aureus)。與類固醇和免疫抑制劑相比,該候選療法旨在解決特應性皮炎背后的微生物組缺陷,以提供一條緩解更持久且副作用更少的潛在新治療途徑。
