11月15日,中國國家藥監局藥品審評中心(CDE)官網最新公示,阿斯利康(AstraZeneca)申報的1類新藥AZD0486獲批兩項臨床試驗默示許可,分別擬用于治療成人既往未經治療的濾泡性淋巴瘤;至少接受2線或以上系統性治療的成人復發難治性濾泡性淋巴瘤。
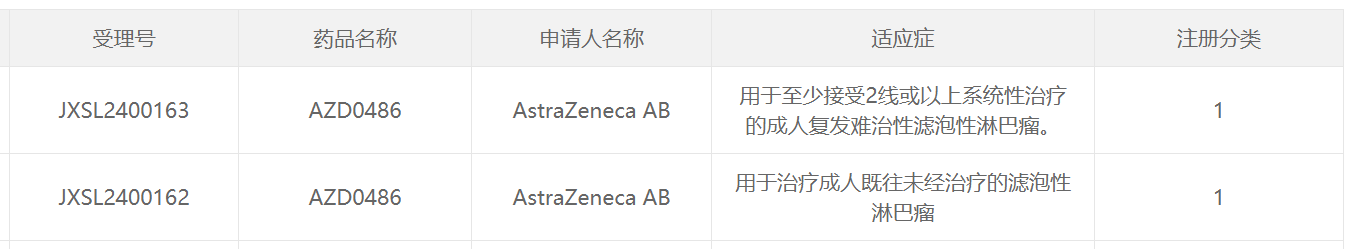 截圖來源:CDE官網
截圖來源:CDE官網
AZD0486的一端可與B細胞表面表達的CD19抗原相結合,另一端與T細胞表面的CD3受體相結合,從而將T細胞重定向到腫瘤細胞,誘導T細胞對腫瘤細胞的殺傷。2022年8月,阿斯利康宣布以總金額超12億美元完成對TeneoTwo公司的收購,從而獲得后者這款在研產品(先前名為TNB-486)。
研究表明,AZD0486含有獨特的低親和力抗CD3片段,旨在減少細胞因子釋放,同時保留T細胞介導的對惡性B細胞的有效細胞毒性。沉默的Fc段可防止非特異性結合及抗體依賴性細胞毒性,并具有適合間歇性給藥的長半衰期。
在今年的美國血液學會(ASH)年會當中,阿斯利康公布旗下多款血液學管線的臨床結果。其中一項臨床1期試驗結果顯示,復發/難治性濾泡性淋巴瘤(R/R FL)患者對2.4毫克及以上劑量的AZD0486高度應答,患者的總緩解率高達96%,完全緩解(CR)率達85%,且患者的最小殘留病灶(MRD)陰性比率很高。
根據ClinicalTrials官網,阿斯利康正在開展一項評估AZD0486聯合利妥昔單抗治療此前未經治療的濾泡性淋巴瘤的3期臨床研究,以及一項針對復發或難治性B細胞非霍奇金淋巴瘤(包括濾泡性淋巴瘤)1期臨床研究。
在中國,AZD0486治療復發性或難治性B細胞急性淋巴細胞白血病此前已經獲CDE臨床試驗默示許可。本次在中國獲批新的IND,意味著其在中國也迎來新的研發進展。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..