1. 阿斯利康(AstraZeneca)雙特異性T細胞接合器AZD0486治療復發/難治性濾泡性淋巴瘤(R/R FL)患者的1期臨床試驗結果亮眼,接受2.4 mg及以上劑量患者的總緩解率(ORR)高達96%,完全緩解(CR)率達85%。
2. 潛在“first-in-class”的menin抑制劑revumenib聯用venetoclax和去甲基化劑(HMA)ASTX727治療攜帶特定基因變異的急性白血病患者,在一項1/2期研究中的ORR達88%。
3. 潛在“best-in-class”合成致死療法TNG462的早期臨床結果積極,多種癌癥類型患者的腫瘤有縮小。
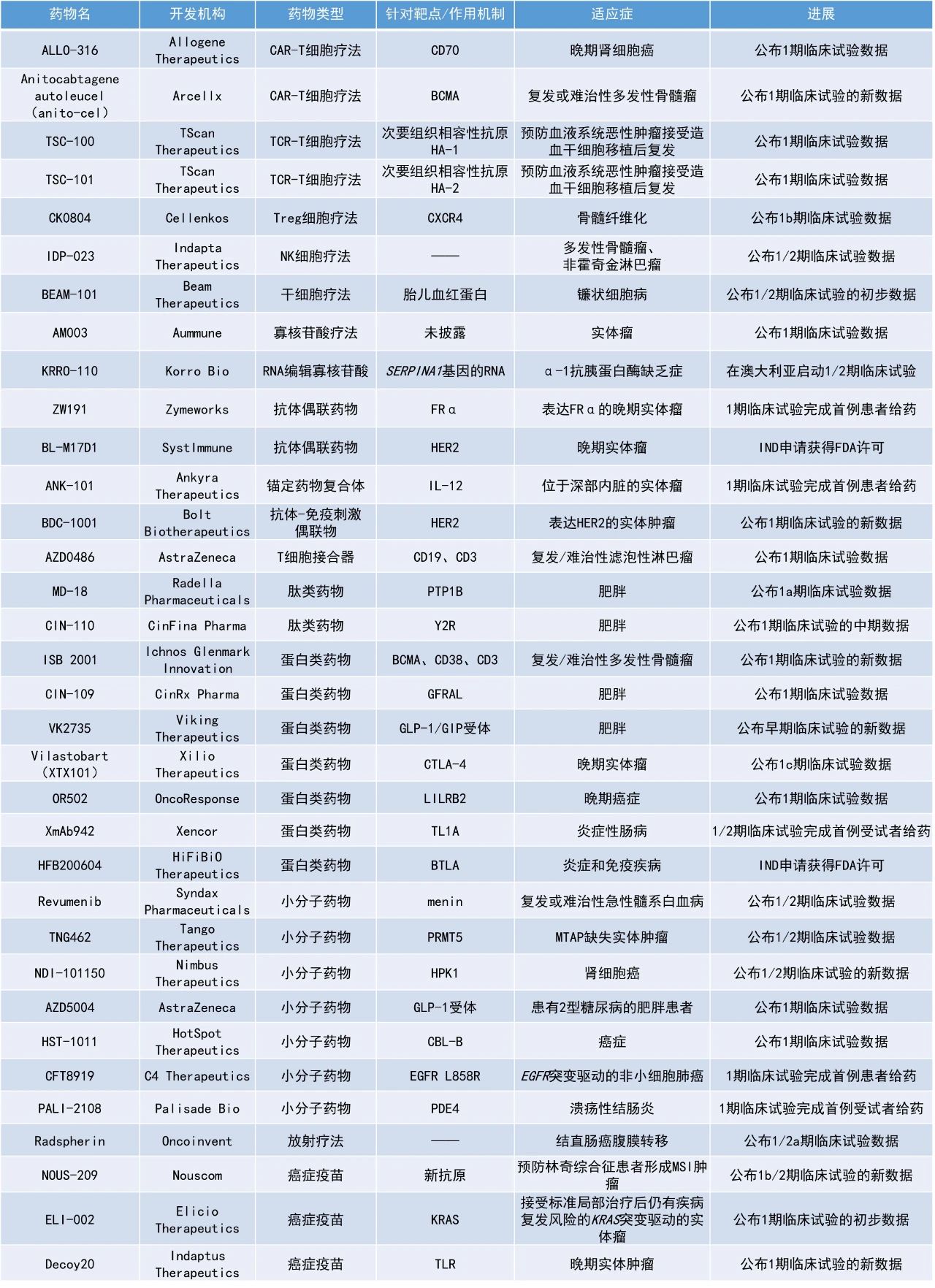
阿斯利康宣布將在今年的美國血液學會(ASH)年會上公布旗下多款血液學管線的臨床結果,其中包括該公司的CD19 x CD3靶向雙特異性T細胞接合器AZD0486用于復發/難治性濾泡性淋巴瘤患者的1期臨床試驗結果。結果顯示,R/R FL患者對2.4 mg及以上劑量的AZD0486高度應答,患者的ORR高達96%,CR達85%,且患者的最小殘留病灶(MRD)陰性比率很高。此外,1期試驗中期結果也顯示,接受過大量治療的彌漫大B細胞淋巴瘤(DLBCL)患者也對AZD0486高度應答,患者的CR率高。最新數據還顯示AZD0486具有良好的安全性,雙倍遞增給藥方案可有效緩解患者發生細胞因子釋放綜合征(CRS)和免疫效應細胞相關神經毒性綜合征(ICANS)事件。Syndax Pharmaceuticals公司宣布將在ASH年會上公布其在研療法revumenib聯用venetoclax和去甲基化劑ASTX727(decitabine/cedazuridine)治療攜帶KMT2A重排、NUP98重排或NPM1突變的復發/難治性急性髓系白血病(r/r AML)或混合譜系急性白血病(MPAL)兒童和成人患者的1/2期臨床試驗結果。Revumenib是一種針對menin-KMT2A相互作用的強效、選擇性小分子抑制劑。截至2024年7月的數據,共有26名患者入組該試驗,ORR為88%(23/26),CR或帶部分血液學恢復的完全緩解(CRh)率為58%(15/26)。15名達到CR/CRh的患者中有14名的MRD狀態可評估,其中93%(13/14)為MRD陰性。中位隨訪時間為6.6個月時,患者6個月時的無復發生存率為59%,總生存率為74%。CR/CRh患者的中位緩解持續時間尚未達到。該組合療法總體上耐受性良好。Tango Therapeutics公司宣布,基于在研療法TNG462在1/2期臨床試驗劑量遞增和早期劑量擴展隊列中獲得的積極數據,該公司已選擇TNG462進入全面開發。新聞稿指出,TNG462是一種潛在“best-in-class”的甲硫腺苷(MTA)協同的蛋白精氨酸甲基轉移酶5(PRMT5)抑制劑。PRMT5是甲硫腺苷磷酸化酶(MTAP)突變的合成致死靶點。MTAP基因缺失發生在大約10%的癌癥中,包括胰腺癌、肺癌和膀胱癌,這些患者體內存在異常升高的MTA水平,從而抑制PRMT5的活性。PRMT5是一種參與基本細胞功能的酶,MTA的升高使得腫瘤細胞對額外PRMT5的抑制變得更為敏感。TNG462是一款基于合成致死理念設計的精準抗癌療法,它可在抑制MTAP缺失細胞中PRMT5功能的同時,保留健康細胞中的PRMT5功能,從而選擇性地殺死腫瘤細胞。截至2024年10月20日,共有59名患者入組,其中39名患者可評估,涵蓋13種癌癥類型。數據顯示,TNG462在多種腫瘤類型中展現了抗癌活性且耐受性良好,包括非小細胞肺癌(NSCLC)和胰腺癌。多種腫瘤類型的腫瘤體積隨著持續治療而縮小,約60%最初被評估為疾病穩定(SD)的患者在之后出現部分緩解(PR)。盡管目前大多數癌癥類型的患者數和隨訪時間不足以準確估算客觀緩解率,但在已入組的7名膽管癌患者中,觀察到其中3名(43%)患者獲得確認的客觀緩解。此外,TNG462在活性劑量下具有良好的安全性和耐受性,劑量限制性毒性(DLT)為血小板減少。該藥物的其他不良事件(如惡心、嘔吐、腹瀉和疲勞)發生率低于20%,且主要為1級。Ichnos Glenmark Innovation公司宣布將在ASH年會上進行口頭報告,展示其三特異性抗體ISB 2001用于復發/難治性多發性骨髓瘤(r/r MM)的1期研究的數據。ISB 2001同時靶向MM細胞上的BCMA和CD38,以及T細胞上的CD3,旨在增加對MM細胞的特異性結合,同時最大限度地減少脫靶效應。截至2024年7月的數據,12名可評估療效患者的ORR為75%(9/12),其中包括1例MRD陰性的嚴格CR。安全性方面,ISB 2001具有良好的安全性和耐受性,未觀察到DLT,僅有一例高于2級的特殊關注不良事件,且沒有因治療而停藥的情況。Vilastobart(XTX101):公布1c期臨床試驗數據Xilio Therapeutics公司公布了其正在進行的1c期臨床試驗的初步臨床數據,該試驗評估了vilastobart(XTX101)聯用PD-L1抑制劑atezolizumab治療晚期實體瘤患者的效果。Vilastobart是一種腫瘤激活、Fc增強、高親和力結合的抗CTLA-4抗體。截至2024年10月7日,17名患者接受了vilastobart聯用atezolizumab的治療。觀察到兩名患有難以治療的、免疫學上為“冷腫瘤”的患者達到了未確認的PR。在1名微衛星穩定型結直腸癌(MSS CRC)患者中觀察到轉移性肝臟病灶的完全消退。安全性數據顯示,該聯合治療總體上耐受良好,vilastobart有潛力成為與PD-1/PD-L1抑制劑聯合使用的差異化下一代抗CTLA-4抗體。Viking Therapeutics在肥胖協會年會肥胖周(ObesityWeek)上公布了其在研減重療法胰高血糖素樣肽1(GLP-1)/葡萄糖依賴性胰島素促泌肽(GIP)受體聯合激動劑VK2735的最新臨床試驗數據。分析顯示,接受每日VK2735口服片劑28天的受試者,其安慰劑調整后平均體重較基線減輕達6.8%。而接受每周VK2735皮下注射治療13周的肥胖患者的平均體重則較基線減輕達14.7%。值得一提的是,在試驗第一周時便觀察到接受皮下劑型患者顯著的體重減輕效果,近100%患者在停藥4周后其體重減輕的大部分效果仍然維持。目前該公司正在規劃VK2735注射劑型的3期研究,以及口服劑型的2期研究,詳細信息將在接近試驗啟動時間時公布。阿斯利康公司公布了在研口服GLP-1療法AZD5004,在患有2型糖尿病的肥胖患者中進行的1期臨床試驗的最新結果。AZD5004是一款每日一次、低劑量的小分子GLP-1受體激動劑,該藥物在臨床前研究中證明具有理想的療效和安全性。去年11月,阿斯利康與誠益生物(Eccogene)達成獨家協議,以潛在18.25億美元的總額獲得小分子GLP-1受體激動劑ECC5004(即AZD5004),用于治療包括肥胖癥、2型糖尿病和其他合并癥在內的適應癥。此次公布的數據顯示,接受劑量為50 mg的AZD5004治療的患者中,4周后患者體重與基線相比降低5.8%,約為9.4斤。同時,患者的空腹血糖等指標也有所下降。CIN-109、CIN-110:公布1期臨床試驗數據CinFina Pharma公司公布了其CIN-110的單劑量遞增(SAD)研究的初步中期數據以及CIN-109的多劑量遞增(MAD)研究的最終數據。CIN-110是一種強效、高選擇性的肽YY(PYY3-36)類似物,具有延長的半衰期,旨在顯著減少其他PYY分子觀察到的惡心和嘔吐,同時促進有效的長期體重減輕。CIN-109是一種新型長效生長分化因子15(GDF-15)類似物,有可能減少食欲、維持能量消耗和促進體重減輕,同時保持瘦體重。兩項研究均顯示這些候選療法具有良好的耐受性,并能導致顯著的體重減輕。CIN-110的1期研究共納入24名平均BMI為34 kg/m²的肥胖受試者,在給藥一周內,他們的食物攝入量減少了28%,體重最多下降了1.8%。總共報告了3例輕度惡心,通常在給藥后12-48小時內出現,并在一天內緩解。在CIN-109的1期研究中,平均BMI為35 kg/m²的肥胖受試者的食物攝入量呈劑量依賴性的減少,最高達50%,患者在1-2個月內體重減輕了多達3.7%。此外,每兩周給藥一次CIN-109的耐受性更好,大部分減輕的體重來自于脂肪,且未觀察到與治療相關的嚴重副作用。
