美國(guó) FDA 仿制藥辦公室(OGD)Iilun Murphy 在普享藥協(xié)會(huì)(AAM)2024 年 GRx+Biosims 會(huì)議上表示,F(xiàn)DA 正在推出一項(xiàng)為期六個(gè)月的新試點(diǎn)計(jì)劃,以在復(fù)雜監(jiān)管問(wèn)題上為仿制藥申請(qǐng)人提供更多透明度。
Murphy 介紹指出,這項(xiàng)試點(diǎn)計(jì)劃將于下個(gè)月推出,旨在響應(yīng)行業(yè)的反饋,并將“盡可能向申請(qǐng)人提供有關(guān)仿制藥申請(qǐng)延遲行動(dòng)的問(wèn)題性質(zhì)的更多說(shuō)明。”
FDA 將評(píng)估這種透明度的提高是否對(duì)行業(yè)有幫助。FDA 希望試點(diǎn)計(jì)劃能夠提高申請(qǐng)質(zhì)量并增加更早的批準(zhǔn)數(shù)量。
Murphy 表示,隨著新問(wèn)題的出現(xiàn)和 FDA 尋求解決方案,“如果我們對(duì)這個(gè)問(wèn)題的看法對(duì)行業(yè)有幫助”,F(xiàn)DA 將提供更及時(shí)的指南。但同時(shí),F(xiàn)DA 也將繼續(xù)推進(jìn)具體申請(qǐng),因此在對(duì)單個(gè)申請(qǐng)采取行動(dòng)和分享有關(guān) FDA 當(dāng)前想法的更廣泛指南之間可能會(huì)存在延遲。
Murphy 強(qiáng)調(diào)仿制藥申報(bào)中需要更好的數(shù)據(jù)質(zhì)量和可靠性,并指出,約 40% 的仿制藥在申報(bào)流程的第二輪審評(píng)中才獲得批準(zhǔn),也就是說(shuō) 40% 的獲批仿制藥曾收到過(guò)一封完全回應(yīng)函(CRL)。
Murphy 在會(huì)上用一張幻燈片展示了 2023 財(cái)年仿制藥申請(qǐng)?jiān)诘谝粋€(gè)審評(píng)周期被拒絕的原因:
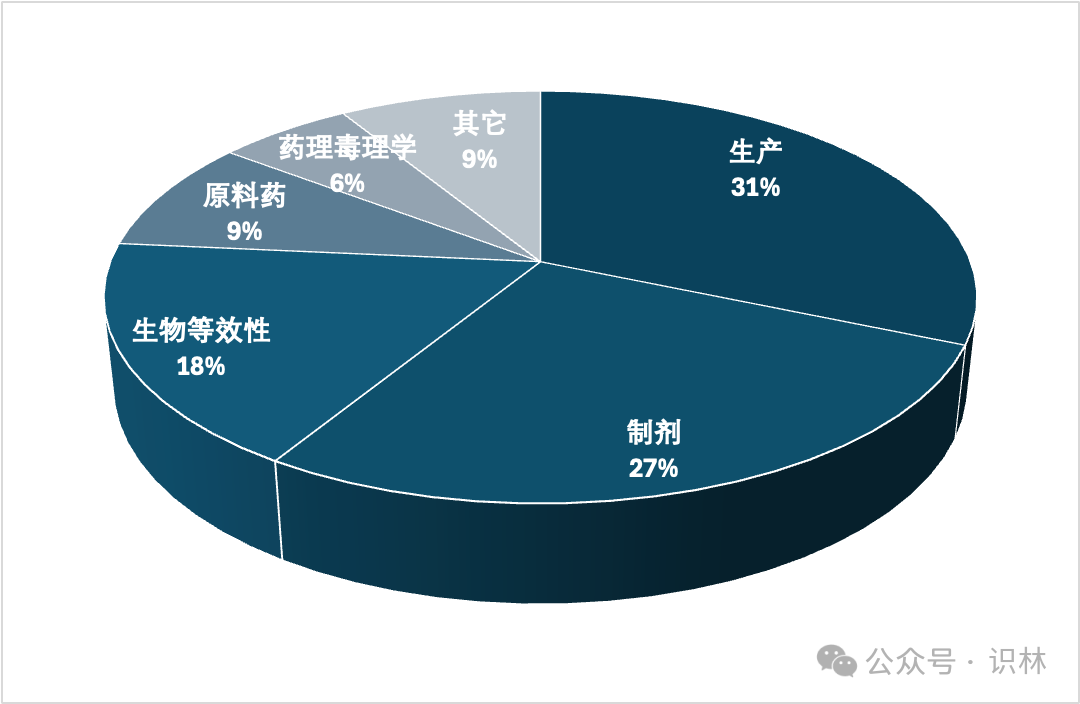
Murphy 表示,“我們希望減少ANDA獲得批準(zhǔn)所需的審評(píng)周期數(shù)”。她補(bǔ)充指出,去年仿制藥辦公室與申辦人就產(chǎn)品開(kāi)發(fā)和 CRL 后澄清問(wèn)題舉行了最多數(shù)量的會(huì)議。
仿制藥使用者付費(fèi)重新授權(quán)(GDUFA)在行業(yè)和 FDA 之間建立了幾種新的會(huì)議類(lèi)型,其中包括討論具體產(chǎn)品指南的會(huì)議,ANDA 申請(qǐng)人可以通過(guò)這類(lèi)會(huì)議從 FDA 獲得關(guān)于新發(fā)布或修訂的具體產(chǎn)品指南建議。但 Murphy 表示,“很奇怪,業(yè)界幾乎沒(méi)有有效利用這類(lèi)會(huì)議。”
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)組織召開(kāi)
2025版《中國(guó)藥典》將于2025年10月..關(guān)于舉辦四川省藥品生產(chǎn)企業(yè)擬新任質(zhì)量
各相關(guān)企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)召開(kāi)第七
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)第七..“兩新聯(lián)萬(wàn)家,黨建助振興”甘孜行活動(dòng)
為深入貫徹落實(shí)省委兩新工委、省市..學(xué)習(xí)傳達(dá)中央八項(xiàng)規(guī)定精神專(zhuān)題會(huì)議
2025年4月22日,協(xié)會(huì)黨支部組織召..關(guān)于收取2025年度會(huì)費(fèi)的通知
各會(huì)員單位: 在過(guò)去的一年里,..四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)..四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)..