10月17日,中國國家藥監局(NMPA)藥品審評中心(CDE)官網最新公示,默沙東(MSD)申報的注射用sotatercept上市申請獲得受理。公開資料顯示,這是一款“first-in-class”新型激活素信號抑制劑類生物制劑,該產品已經于今年3月獲得美國FDA批準上市,用于治療肺動脈高壓(PAH)。這款療法此前被行業媒體Evaluate評為2024年潛在重磅的療法之一。
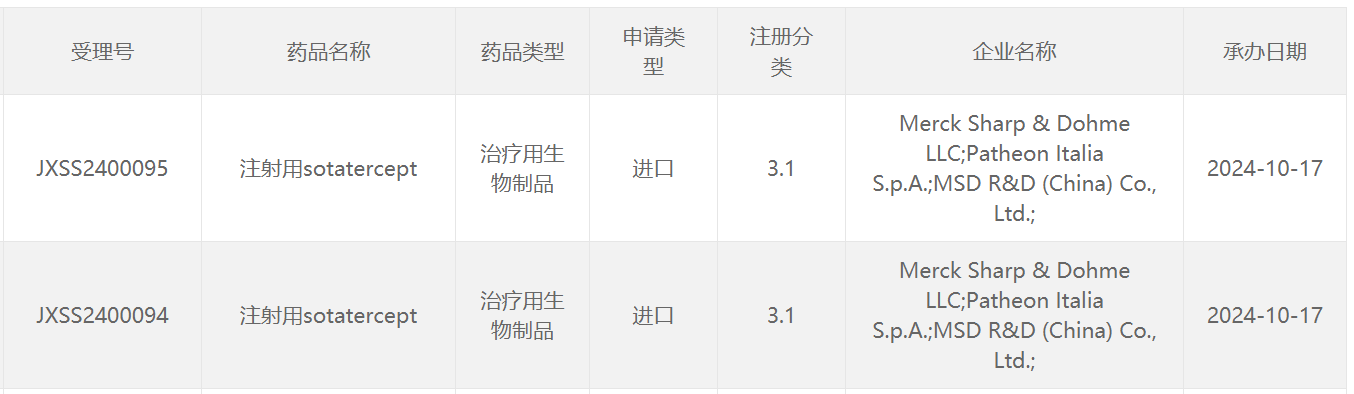
截圖來源:CDE官網
PAH是一種罕見、進行性、危及生命的血管疾病,當肺部的小動脈變厚并變窄時,會導致這些動脈內的壓力增加,對心臟造成壓力。PAH可引起心臟負荷明顯增加,導致體力活動受限、心力衰竭和預期壽命縮短。PAH的發生涉及三個相關過程,包括炎癥、細胞增殖和纖維化,這些過程在肺部小動脈的增厚、變窄和僵硬中起著重要作用,通常被稱為“血管重塑”。目前批準的PAH療法主要是作為血管擴張劑打開血管,但這些治療無法逆轉由炎癥、增殖和纖維化引起的血管重塑。
Sotatercept是一款IIA型激活素受體(ActRIIA)融合蛋白。它將ActRIIA經過改造的細胞外域與抗體的Fc端融合在一起,可以阻斷激活素與細胞膜上的受體結合,從而降低激活素介導的信號傳導。在臨床前研究中,它可以逆轉肺動脈壁和右心室的重塑。該產品也是默沙東于2021年以約115億美元收購Acceleron Pharma公司獲得的關鍵療法。此前,sotatercept已獲得FDA授予的突破性療法認定,用于治療肺動脈高壓。
FDA批準sotatercept是基于一項隨機雙盲,含安慰劑對照的關鍵性3期臨床試驗STELLAR的結果。2023年3月,默沙東公布了該關鍵性3期臨床試驗完整結果,該研究結果也在《新英格蘭醫學雜志》同步發表。
研究結果顯示,在PAH患者中,sotatercept在治療24周后將患者的6分鐘步行距離(6MWD)與基線相比提高了40.8米。此外,sotatercept還對9項次要終點中的8項提供統計顯著和具有臨床意義的改善,包括WHO功能分級和肺血管阻力方面的改善。與安慰劑相比,在中位隨訪時間為32.7周時,它將患者的疾病臨床惡化或死亡風險降低84%。
默沙東此前新聞稿表示,這些具有里程碑意義的結果彰顯了在肺動脈高壓治療領域,sotatercept以及與血管過度增殖和病理性重塑相關的靶向細胞信號方法的治療潛力。
2023年9月,默沙東公布了該研究的一項探索性事后分析結果。結果表明,sotatercept在治療PAH患者24周后,可縮小心臟右側大小,并且改善右心室功能和血液動力學指標。
在中國,sotatercept于去年9月獲批臨床,針對適應癥即為肺動脈高壓。根據藥物臨床試驗登記與信息公示網站,默沙東此前已經完成了一項在健康中國受試者中評價sotatercept的安全性、耐受性和藥代動力學的單次給藥1期臨床研究。本次該產品在中國的上市申請獲得受理,意味著其研發進程迎來重要進展,有望在不久的將來造福中國患者。
參考資料:
[1]中國國家藥監局藥品審評中心官網. Retrieved Oct 17, 2024, from https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2]默沙東公布在研藥物sotatercept III期STELLAR研究數據. Retrieved Mar 7,2023. From https://mp.weixin.qq.com/s/viNQdtj1-LTjojrhAKWTIA
[3] Prescribing information. Retrieved March 26, 2024 https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/761363s000lbl.pdf
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..