9 月 25 日,CDE 官網顯示,榮昌生物「維迪西妥單抗」一項新適應癥擬納入優先審評,用于既往接受過曲妥珠單抗或其生物類似物和紫杉類藥物治療的 HER2 陽性(HER2 免疫組織化學檢查結果為 3+或 FISH+)存在肝轉移的晚期乳腺癌患者。
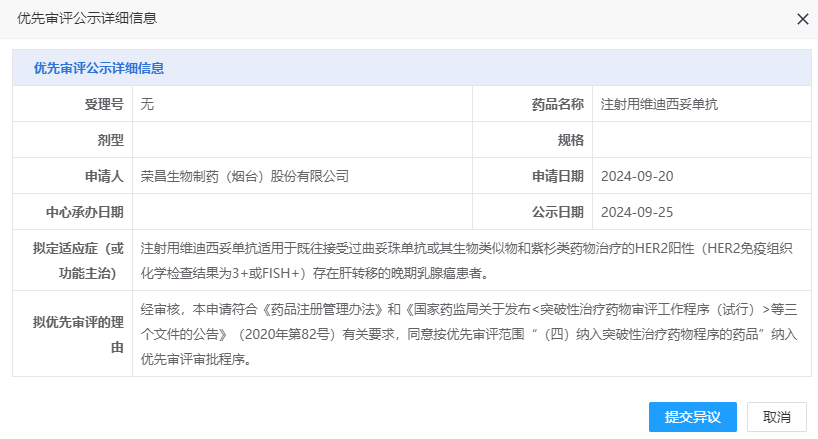
截圖來源:CDE 官網
6 月 13 日,榮昌生物宣布,維迪西妥單抗治療 HER2 陽性存在肝轉移的晚期乳腺癌患者的 III 期臨床取得陽性結果,達到主要研究終點,即將申報上市。該研究在 2021 年 6 月獲 NMPA 授予的突破性療法認定。
這是一項在中國開展的、開放、平行對照、多中心的Ⅲ期臨床研究(RC48-C006,NCT03500380),旨在評價注射用維迪西妥單抗對比拉帕替尼聯合卡培他濱用于治療 HER2 陽性晚期乳腺癌患者的有效性及安全性。
根據本研究最終分析結果顯示,與拉帕替尼聯合卡培他濱相比,注射用維迪西妥單抗可顯著延長患者的無進展生存期 (PFS)。注射用維迪西妥單抗安全性數據與已知風險相似,未發現新的安全性信號。具體研究結果將在學術期刊或重大學術會議上予以公布。
維迪西妥單抗采用人源化 HER2 抗體,以 MMAE 作為毒素載荷,通過可被組織蛋白酶剪切的連接子(MC-Val-Cit PAB)偶聯,藥物-抗體比率為 4:1。
目前,維迪西妥單抗已在國內獲批兩項適應癥,分別為二線尿路上皮癌和三線胃癌。
在乳腺癌領域,除了 HER2 陽性人群外,維迪西妥單針對 HER2 低表達乳腺癌人群的臨床研究也正處于 III 期臨床研究中(NCT04400695)。
在胃癌領域,除了已獲批的三線療法外,維迪西妥單抗聯合卡度尼利單抗二線治療 HER2 表達局部晚期或轉移性胃癌也正在開展 II/III 臨床研究(NCT06221748)。
在尿路上皮癌領域,有兩個一線療法正在推進III期臨床(NCT05302284,NCT03809013)
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..