本期看點
1. 治療阿爾茨海默病(AD)的自然殺傷(NK)細胞療法SNK01在一項1期臨床試驗中使90%患者的認知功能穩定或有改善。
2. FDA批準了能在體內制造嵌合抗原受體(CAR)-T細胞的創新療法UB-VV111的IND申請,預計將于今年年底前啟動1期臨床試驗。
3. 有望功能性治愈乙型肝炎病毒(HBV)感染的重組多克隆抗體療法GIGA-2339獲許可進入臨床。
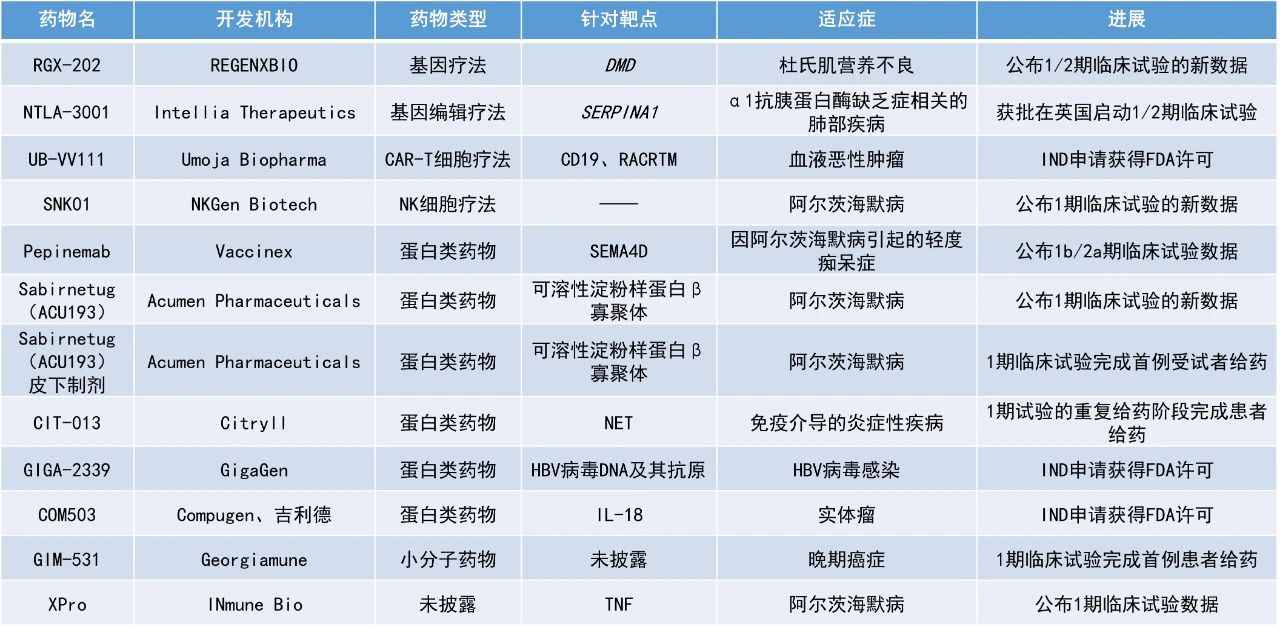
SNK01:公布1期臨床試驗的新數據
NKGen Biotech公布了其在研NK細胞療法SNK01治療阿爾茨海默病患者的臨床試驗數據。SNK01是一款自體、非基因工程改造的NK細胞產品,它具有增強的細胞毒性,活化受體表達率超過90%,可從任何供體中穩定生產。該候選療法能夠有效降低AD患者腦脊液(CSF)中的α-突觸核蛋白(α-syn)水平,該蛋白的升高被認為與認知能力下降有關。目前,已批準的AD療法均未將α-syn作為靶點。
此前公布的1期試驗結果顯示,SNK01除了先前披露的對淀粉樣蛋白β(Aβ)和神經炎癥生物標志物的積極影響外,對晚期AD患者的認知功能也具有臨床療效。在10名可評估的AD患者中,90%患者的阿爾茨海默病綜合評分(ADCOMS,一種反映患者認知功能的評分)較基線時有改善或保持穩定。
此次公布的結果顯示,盡管70%的受試者接受的是相對低劑量的SNK01治療,仍有60%的受試者(6/10)的CSF α-syn水平較基線時有所下降。第11周時,6名患者中有5名受試者的α-syn下降與ADCOMS的穩定/下降相對應。安全性方面,沒有觀察到與治療相關的不良事件。AD受試者對SNK01的耐受性良好,在所有測試劑量下均未觀察到劑量限制性毒性。該公司表示,這些數據值得在更大劑量、更長療程、更大規模的2期試驗中進一步研究。
UB-VV111:IND申請獲得FDA許可
Umoja Biopharma宣布,美國FDA已批準其在研CD19靶向原位生成(in-situ generated)CAR-T細胞療法UB-VV111的IND申請,用以治療血液惡性腫瘤。Umoja預計將在2024年底前啟動1期試驗并進行首位患者給藥。根據新聞稿,UB-VV111可能是血液學人體試驗中首個原位生成CD19靶向CAR-T細胞療法。
UB-VV111是一款通過VivoVec平臺開發的體內CAR-T細胞療法。UB-VV111包含一個表面經過工程化的病毒包膜,以及編碼CD19靶向CAR和雷帕霉素激活細胞因子受體(RACRTM)的轉基因,旨在于患者體內擴增UB-VV111工程化CAR-T細胞。該療法是VivoVec基因遞送平臺進入臨床的首個管線。
GIGA-2339:IND申請獲得FDA許可
GigaGen公司宣布,美國FDA已批準其IND申請,將于2024年第四季度啟動一項1期試驗,以評估該公司首款用于治療HBV感染的重組多克隆抗體療法GIGA-2339。GIGA-2339采用GigaGen的下一代平臺開發,含有1000多種全人重組抗HBV抗體,旨在復制人體的自然免疫反應。GIGA-2339的效力是血漿衍生HBV藥物的2000多倍,涵蓋了廣泛的循環HBV變異。在小鼠模型中,GIGA-2339中和并清除了HBV的病毒DNA及其抗原。通過這種獨特的作用機制,GIGA-2339有可能清除病毒顆粒并激活免疫反應,從而提供HBV感染患者的功能性治愈。
Sabirnetug(ACU193):公布1期臨床試驗的新數據
Acumen Pharmaceuticals公司公布了sabirnetug(ACU193)用于治療AD的1期臨床試驗的新結果。Sabirnetug是一種選擇性靶向毒性可溶性β淀粉樣蛋白寡聚體(AβOs)的人源化單克隆抗體。Sabirnetug能夠結合AβOs,由于其獨特的結合特性,sabirnetug有可能在產生淀粉樣蛋白相關成像異常(ARIA,一種抗體療法產生的常見主要副作用)風險較低的情況下提供治療益處,因為sabirnetug可以在不直接靶向淀粉樣斑塊的情況下阻斷AβOs的毒性作用。
此次公布的結果顯示,接受sabirnetug給藥3次可顯著降低患者腦脊液中突觸前和突觸后蛋白水平,這與sabirnetug抑制AβOs突觸結合的作用機制一致。VAMP2是一種與突觸損傷相關的生物標志物,在所有多劑量遞增組中均顯著降低,似乎是該研究中發現的對sabirnetug最敏感的生物標志物。Acumen公司計劃在正在進行的為期18個月的2期臨床試驗中評估生物標志物的長期變化及其與臨床結果的關系,以進一步證實sabirnetug的作用機制。此外,Acumen公司還宣布了sabirnetug皮下制劑治療早期AD的1期臨床試驗已完成首例受試者給藥。
Pepinemab:公布1b/2a期臨床試驗數據
Vaccinex公司公布了pepinemab治療AD的1b/2期試驗數據的良好初步結果。Pepinemab是一種人源化IgG4單克隆抗體,旨在阻斷SEMA4D與plexin-B1受體結合,從而避免引發細胞內肌動蛋白細胞骨架的崩潰,以及進一步導致的大腦中星形膠質細胞和其他膠質細胞以及免疫組織中樹突狀細胞的穩態功能喪失。
此次公布的結果證實了以激活星形膠質細胞為目標的新型作用機制有望延緩AD從早期輕度認知障礙發展為老年癡呆癥的進程。該研究結果與此前pepinemab治療亨廷頓病的2期臨床試驗結果類似,因為AD與亨廷頓病在神經免疫病理學方面具有相似性。
RGX-202:公布1/2期臨床試驗的新數據
REGENXBIO公司宣布,其在研杜氏肌營養不良癥(DMD)基因療法RGX-202在治療1至11歲DMD患者的1/2期臨床試驗中獲得了積極的中期安全性和療效數據。在接受關鍵性臨床試驗推薦劑量(劑量水平2)的RGX-202治療的5.8歲和8.5歲患者中,接受治療后三個月時微抗肌營養不良蛋白表達水平分別為健康對照組的77.2%和46.5%。
RGX-202是一種一次性基于腺相關病毒載體(AAV)的基因療法,它編碼包含天然抗肌營養不良蛋白C端(CT)結構域的微抗肌營養不良蛋白,以更好地模擬天然蛋白的功能。臨床前研究中,CT結構域已被證明可以保護肌肉免受收縮引起的應力,并提高其自我修復的能力。
XPro:公布1期臨床試驗數據
INmune Bio公司公布了其下一代腫瘤F壞死因子(TNF)抑制劑XPro用于治療AD的1b期臨床試驗結果。XPro的作用與現有的TNF抑制劑不同,它能中和可溶性TNF(sTNF),而不影響跨膜TNF(tmTNF)或TNF受體。XPro可在不抑制免疫的情況下減輕神經炎癥,從而對神經系統疾病患者產生潛在的實質性益處。此次公布的結果顯示,接受XPro治療12周后,患者的突觸蛋白發生了顯著變化,而突觸蛋白對神經元之間的交流至關重要。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..