生物制品是以微生物、細(xì)胞、動物或人源組織和體液等為起始原料,用生物學(xué)技術(shù)制成,用于預(yù)防、治療和診斷人類疾病的制劑,如疫苗、血液制品、生物技術(shù)藥物、微生態(tài)制劑、免疫調(diào)節(jié)劑、診斷制品等[1]。其中,治療用生物制品在近十年來更是逐漸成為全球醫(yī)藥產(chǎn)業(yè)的發(fā)展重心。
全球年銷售排名前10 位的重磅產(chǎn)品中有8 個是治療用生物藥物[2-3]。生物制品潔凈廠房作為生物制品的生產(chǎn)場所,其設(shè)計不僅要滿足生物制品本身的特殊工藝要求,同時也要考慮消防法規(guī)、節(jié)能、人員和環(huán)境保護(hù)等的要求。因此,生物制品潔凈廠房初步設(shè)計需要綜合考慮較多因素。隨著GMP 的實施以及醫(yī)藥工業(yè)的發(fā)展,生物制品潔凈廠房在實際應(yīng)用過程中暴露出較多問題。部分問題是由于生物制品潔凈廠房設(shè)計過程沒有考慮全面造成。本文以保障藥品的質(zhì)量為出發(fā)點,通過2010 年版GMP 的角度對12 家生物制品潔凈廠房初步設(shè)計存在問題進(jìn)行統(tǒng)計、分析,并提出建議。希望為生物制品潔凈廠房初步設(shè)計提供參考。
1 常見問題概況
12 家生物制品潔凈廠房系統(tǒng)初步設(shè)計共發(fā)現(xiàn)234 項問題,按照問題出現(xiàn)頻次分類:(1)生產(chǎn)工藝布局方面,如人流、物流不設(shè)計不暢等;(2)空氣凈化系統(tǒng),壓差設(shè)置不合理,排風(fēng)設(shè)置不合理等;(3)廠區(qū)整體布局不合理,主要表現(xiàn)在廠區(qū)選址、布局不當(dāng)?shù)确矫妫?4)其他問題,如水系統(tǒng)、電氣系統(tǒng)設(shè)置不當(dāng)?shù)取T斠姳?。

2 問題分析
2.1 生產(chǎn)工藝布局方面
從表1 可以看出,生產(chǎn)工藝布局的問題出現(xiàn)的頻次最多,共有162 項,占有69.2 %的比例,這些問題容易直接影響藥品質(zhì)量。如人流、物流設(shè)計不合理,容易造成產(chǎn)品污染、交叉污染及人員串崗的情況。區(qū)域規(guī)劃不合理,可能對正常生產(chǎn)造成干擾,同時不便于日常監(jiān)測、觀察等。
2.1.1 人流、物流不暢
GMP 規(guī)范第四十條要求:廠區(qū)和廠房內(nèi)的人、物流走向應(yīng)當(dāng)合理[4]。部分設(shè)計人流、物流設(shè)計不暢,容易造成混淆、差錯及污染。如灌裝區(qū)污物傳出需穿越多個操作間,最后通過物料傳入通道傳出潔凈區(qū),操作不便且易造成污染、交叉污染,應(yīng)重新設(shè)計污物退出路線。部分設(shè)計存在操作人員穿越其它操作區(qū)的現(xiàn)象,如發(fā)酵離心間人員需穿越發(fā)酵間和菌體收集間,凍融崗位人員需穿越純化離心間。如此布置不僅會導(dǎo)致操作不便,而且容易造成人員串崗和交叉污染,操作人員應(yīng)按生產(chǎn)實際定崗,做到人員不穿崗,避免迂回。生物制品潔凈廠房工藝布局應(yīng)該按生產(chǎn)過程和操作程序布置,做到物順其流、人行其暢,人流物流合理分開[5]。
2.1.2 區(qū)域規(guī)劃不合理
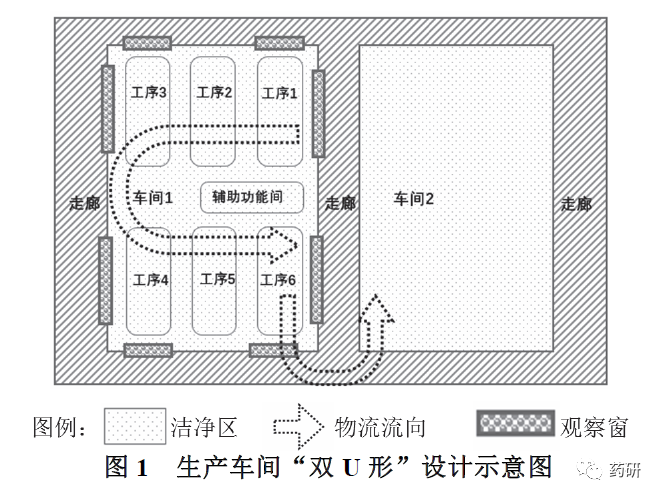
部分設(shè)計將關(guān)鍵工序布置在車間布局的內(nèi)部中心位置,如病毒滅活、灌裝等工序,非生產(chǎn)崗位人員(如質(zhì)量保證人員)需要進(jìn)入到核心區(qū)域才能進(jìn)行日常監(jiān)測、觀察,可能會對生產(chǎn)造成干擾。同時,也不利于培養(yǎng)基模擬灌裝、偏差調(diào)查等工作的開展。生產(chǎn)車間較理想的設(shè)計是長條式流水線操作的設(shè)計,但生產(chǎn)企業(yè)一般沒有足夠的空間來建造此類廠房。部分設(shè)計通過“U 型”布置來達(dá)到上述效果:將關(guān)鍵工序設(shè)置在車間布局的外圍(如圖1),輔助車間設(shè)計在中間,通過這種設(shè)計,非生產(chǎn)崗位人員可以通過觀察窗對關(guān)鍵工序進(jìn)行觀察,而不對正常生產(chǎn)造成干擾。同時,前后工序的車間也可以通過“U 型”設(shè)計來進(jìn)行連接,如疫苗制品的原液車間與制劑車間,通過這種設(shè)計可以優(yōu)化人流、物流路線,盡量減少物料的運輸距離。
2.1.3 生產(chǎn)設(shè)備選型與生產(chǎn)需求不適應(yīng)
GMP 規(guī)范附錄生物制品第四十九條要求:使用二類以上病原體進(jìn)行生產(chǎn)時,對產(chǎn)生的污物和可疑污染物品應(yīng)當(dāng)在原位消毒,完全滅活后方可移出工作區(qū)[6]。部分設(shè)計未考慮有菌(毒)操作區(qū)物品的傳出方式,缺乏相應(yīng)的配套設(shè)備。如有菌(毒)操作區(qū)生產(chǎn)過程中產(chǎn)生的固體廢物和廢液,可能存在未滅活的病菌。因此在此操作區(qū)的所有涉及的物品,如工作服、器具、廢棄的收獲液、CIP站產(chǎn)生的廢水等,均需要經(jīng)過驗證的方法進(jìn)行滅活,將生產(chǎn)用病菌殺死后才能離開此區(qū)域。固體廢物如不銹鋼器具、工作服等可通過蒸汽高壓鍋消毒滅菌后傳出[7]。不能耐受高溫、高壓的器具,如溫度計、壓力表等精密儀表可選擇汽化過氧化氫滅菌柜(Vaporized Hydrogen Peroxide/VHP)等進(jìn)行滅菌后傳出,部分設(shè)計采用臭氧熏蒸的方式進(jìn)行滅菌,應(yīng)評估其是否能達(dá)到預(yù)期的滅菌效果。
2.2 空氣凈化系統(tǒng)
空氣凈化系統(tǒng)的主要目的是確保生物制品的環(huán)境空氣品質(zhì)和防止交叉污染。如果藥品生產(chǎn)環(huán)境得到妥善的設(shè)計、建造、調(diào)試、運行和維護(hù),則有助于確保產(chǎn)品的質(zhì)量,提高產(chǎn)品的可靠性[8]。從表1 可以看出,空氣凈化系統(tǒng)的問題共有45 項,占有19.2 %的比例,如壓差設(shè)置不合理,排風(fēng)設(shè)置不合理等。
2.2.1 壓差設(shè)置不當(dāng)
GMP 規(guī)范第四十八條要求:潔凈區(qū)與非潔凈區(qū)之間、不同潔凈級別潔凈區(qū)之間壓差應(yīng)不低于10 帕斯卡。必要時,相同潔凈度級別的不同功能區(qū)域(操作間)之間也應(yīng)當(dāng)保持適當(dāng)?shù)膲翰钐荻萚4]。部分設(shè)計未考慮特殊品種對負(fù)壓梯度的要求,存在系統(tǒng)變風(fēng)量過程(如生物安全柜啟停、備用送/排風(fēng)機(jī)組切換等)引起的壓力梯度波動的問題。通過差值風(fēng)量控制法調(diào)節(jié)各房間送風(fēng)量與排風(fēng)量的差值來保證各房間的壓力梯度,可較好的解決上述問題[9]。同時,設(shè)計要考慮負(fù)壓梯度大小與節(jié)能的問題。當(dāng)有較大的負(fù)壓時,能夠有效防止致病生物因子氣溶膠的外泄,但建設(shè)費用和運營花費較高;相反的,當(dāng)負(fù)壓較小時,極易產(chǎn)生致病生物因子氣溶膠外泄,對生產(chǎn)區(qū)及外部都會造成安全問題[10]。
2.2.2 排風(fēng)設(shè)置不合理
GMP 規(guī)范附錄生物制品 第二十二條要求:有菌(毒)操作區(qū)應(yīng)當(dāng)有獨立的空氣凈化系統(tǒng)。來自病原體操作區(qū)的空氣不得循環(huán)使用;來自危險度為二類以上病原體操作區(qū)的空氣應(yīng)當(dāng)通過除菌過濾器排放,濾器的性能應(yīng)當(dāng)定期檢查[6]。部分設(shè)計病原體操作區(qū)的空氣未通過處理后排放,此區(qū)域空氣一般采用直排方式處理,不利用回風(fēng),且有毒區(qū)可盡量靠近動力區(qū)設(shè)置,以達(dá)到節(jié)能的目的。
2.3 廠區(qū)整體布局不合理
從表1 可以看出,部分生物制品潔凈廠房初步設(shè)計仍然存在廠區(qū)整體布局不合理的問題,雖然僅占3.9%的比例,但這類問題在工程實施后不易調(diào)整和整改。如選址不當(dāng),廠區(qū)周圍散發(fā)的有害氣體等容易對藥品生產(chǎn)造成污染。廠區(qū)內(nèi)布局不當(dāng),生活和輔助區(qū)對生產(chǎn)區(qū)造成妨礙。說明在整體規(guī)劃方面仍存在著較大的漏洞或者缺陷。
2.3.1 廠區(qū)選址不當(dāng)
《藥品生產(chǎn)質(zhì)量管理規(guī)范》(2010 修訂,簡稱GMP 規(guī)范)第三十八條要求:廠房的選址、設(shè)計、布局、建造、改造和維護(hù)必須符合藥品生產(chǎn)要求,應(yīng)當(dāng)能夠最大限度地避免污染、交叉污染、混淆和差錯,便于清潔、操作和維護(hù)[4]。部分初步設(shè)計選址不合理,如某企業(yè)選址位于石化工業(yè)區(qū)的附近,石化工業(yè)散發(fā)的有害氣體等容易對藥品生產(chǎn)造成污染。生物制品生產(chǎn)企業(yè)在廠區(qū)選址時,應(yīng)遠(yuǎn)離散發(fā)大量粉塵和有害氣體的場所,避免散發(fā)的有害氣體等容易對藥品生產(chǎn)造成污染。藥品生產(chǎn)企業(yè)廠區(qū)選址是藥品生產(chǎn)規(guī)劃的第一步,企業(yè)應(yīng)綜合考慮自身發(fā)展及區(qū)域規(guī)劃方向等因素,避免在廠區(qū)籌建時就存在先天不足的情況。
2.3.2 廠區(qū)內(nèi)布局不當(dāng)
GMP 規(guī)范第四十條要求:生產(chǎn)、行政、生活和輔助區(qū)的總體布局應(yīng)當(dāng)合理,不得互相妨礙[4]。部分初步設(shè)計在生產(chǎn)區(qū)內(nèi)設(shè)有綜合活動樓、飯?zhí)玫扰涮自O(shè)施,應(yīng)適當(dāng)增設(shè)間隔措施,使廠區(qū)內(nèi)生產(chǎn)區(qū)和生活區(qū)分開,不互相影響。另外,部分設(shè)計只有一個主細(xì)胞庫,沒有考慮備用主細(xì)胞庫。《生物制品生產(chǎn)檢定用動物細(xì)胞基質(zhì)制備及檢定規(guī)程》要求:主細(xì)胞庫和工作細(xì)胞庫應(yīng)分別存放。每一個庫應(yīng)在生產(chǎn)設(shè)施內(nèi)至少2 個不同的地點或區(qū)域存放[1]。主細(xì)胞庫作為生物制品的起始物料,是生物制品上市前臨床評價及上市后研究的物質(zhì)基礎(chǔ),研究過程漫長且復(fù)雜,因此主細(xì)胞庫是生物制品生產(chǎn)企業(yè)生存和發(fā)展基礎(chǔ)。企業(yè)應(yīng)加強(qiáng)對主細(xì)胞庫的保護(hù),確保主細(xì)胞庫在發(fā)生停電、火災(zāi)等應(yīng)急情況時,能夠采取有效的應(yīng)對措施。
2.4 其他
其他的問題共有18 項,占比7.7 %,主要涉及排水系統(tǒng)問題及電氣系統(tǒng)問題,如有毒區(qū)廢水處理考慮不周,配電柜、消火栓等設(shè)置不合理等問題。
2.4.1 水系統(tǒng)方面
水是很多生物制品的載體,一旦受到污染,后果將不堪設(shè)想[11]。部分設(shè)計未考慮注射用水制備、儲存必須要防止微生物的滋生和污染的要求,例如注射用水可采用70 ℃以上保溫循環(huán)[4],在制備后規(guī)定時間內(nèi)使用。同時,為保障生物安全,有毒區(qū)的廢液在處理前必須經(jīng)過滅菌處理,如在地下室設(shè)置了廢液滅活間,將排水管道分別接入廢液滅活間的滅活罐,經(jīng)滅活處理后排至廠區(qū)污水處理站,再經(jīng)處理后排放。
生物制品生產(chǎn)企業(yè)的公用系統(tǒng),如水系統(tǒng)、供氣系統(tǒng)等,在系統(tǒng)排空后,管道內(nèi)會形成空氣通路,病毒、致病菌可以通過管路污染其他系統(tǒng)及環(huán)境,應(yīng)防止病毒、致病菌通過這種途徑污染其他系統(tǒng)及環(huán)境措施。另外,有毒區(qū)和無毒區(qū)的公用工程系統(tǒng)供給時管路宜盡量分開,防止交叉污染[12]。
2.4.2 電氣系統(tǒng)方面
GMP 規(guī)范第七十九條要求:設(shè)備的維護(hù)和維修不得影響產(chǎn)品質(zhì)量。車間內(nèi)生產(chǎn)設(shè)備的日常維護(hù)和維修是保證藥品質(zhì)量不可缺少的一部分,但日常維護(hù)和維修可能會對車間內(nèi)環(huán)境造成不良影響,甚至影響產(chǎn)品質(zhì)量。部分設(shè)計將配電柜、消防栓等設(shè)置在潔凈區(qū)內(nèi),不便于日常維護(hù)和維修。在滿足消防、行業(yè)規(guī)范等前提下,配電柜、消火栓等應(yīng)盡可能設(shè)置在非潔凈區(qū)和無毒區(qū)[13]。
此外,部分設(shè)計中存在較多管線組織外露的問題,不便于潔凈區(qū)內(nèi)清潔維護(hù)。潔凈車間內(nèi)的管線組織應(yīng)該與各類機(jī)房的布置一起規(guī)劃,采取不同的隱蔽措施。如管道豎井作為各類管線豎向集中空間, 應(yīng)盡量毗鄰機(jī)房布置。技術(shù)夾層作為管線水平分散空間, 要為管線的穿行及檢修提供足夠的空間[13]。
3 小結(jié)
生物制品潔凈廠房由于其生產(chǎn)品種的特殊性,決定了工藝流程設(shè)計的復(fù)雜性和公用系統(tǒng)的特殊要求。這些特性對生物制品潔凈廠房初步設(shè)計提出了較高的要求,除了滿足生產(chǎn)工藝要求的基礎(chǔ)外,還要考慮生物安全、消防、環(huán)保規(guī)范等因素。生物制品生產(chǎn)企業(yè)應(yīng)與設(shè)計方充分溝通,使設(shè)計方全面了解生產(chǎn)過程、項目的定位及生產(chǎn)企業(yè)的特殊要求。按照生產(chǎn)過程和操作程序,科學(xué)、合理地進(jìn)行平面布局和設(shè)備布置,最大限度地減少差錯和交叉污染,在設(shè)計過程中不斷地探索、分析和總結(jié),設(shè)計出更優(yōu)化的方案。
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會組織召開
2025版《中國藥典》將于2025年10月..關(guān)于舉辦四川省藥品生產(chǎn)企業(yè)擬新任質(zhì)量
各相關(guān)企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質(zhì)量管理協(xié)會召開第七
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會第七..“兩新聯(lián)萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學(xué)習(xí)傳達(dá)中央八項規(guī)定精神專題會議
2025年4月22日,協(xié)會黨支部組織召..關(guān)于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..