第一屆粵港澳大灣區(qū)中醫(yī)藥高質量發(fā)展峰會
“十四五”開局之年,國家醫(yī)藥產業(yè)創(chuàng)新生態(tài)持續(xù)向好,創(chuàng)新氛圍逐漸形成,中國生物醫(yī)藥創(chuàng)新發(fā)展正在加速駛入“快車道”。在第一屆粵港澳大灣區(qū)中醫(yī)藥高質量發(fā)展峰會暨生物醫(yī)藥與健康產業(yè)集群創(chuàng)新大會上,美國藥學科學家學會(AAPS)中國討論組2020年主席、上海科志康醫(yī)藥科技有限公司CEO張科之在專題報告中指出,我國已進入監(jiān)管科學時代,將引發(fā)藥企在研發(fā)和生產模式上的深度變革。

美國藥學科學家學會(AAPS)中國討論組2020年主席、
上海科志康醫(yī)藥科技有限公司CEO 張科之
進入監(jiān)管科學時代
根據(jù)美國、歐盟和日本在監(jiān)管科學上的發(fā)展,結合國內的現(xiàn)狀,張科之對監(jiān)管科學做了一個歸納,他認為監(jiān)管科學是在評估藥品安全性、療效、質量和臨床性能時,尤其針對新興治療技術如細胞藥物、基因治療等,監(jiān)管部門起草和頒布新工具、新標準和新方法所依據(jù)的科學方法論。
監(jiān)管科學的發(fā)展,ICH的并軌,監(jiān)管部門在審評審批、監(jiān)管和政策制定等方面發(fā)生潛移默化的變化,而企業(yè)在質量合規(guī)、生產管理和研發(fā)戰(zhàn)略上也將發(fā)生革命性改變。
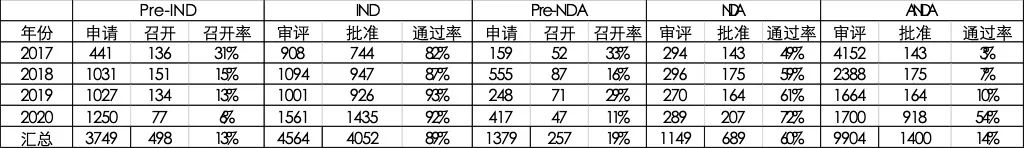
進入監(jiān)管科學時代后,藥品的審評審批也在悄然變化。2017-2020年期間,CDE的審批數(shù)據(jù)是pre-IND、IND和pre-NDA的年復合增長率分別為122.4%、97.6%和117.5%,但NDA和ANDA的年復合增長率卻為-25.7%和-83.9%。
張科之指出,臨床試驗的準入門檻逐年降低,但上市審評的質量沒有降低。近4年內,IND批準率平均高達89%;pre-IND會議的召開率逐年降低,在2020年僅為6%,說明CDE對創(chuàng)新藥物的風險評估能力逐年提升;在嚴守質量前提下,審評速度大幅提升。
表1 近年CDE審評審評匯總
走質量合規(guī)發(fā)展的創(chuàng)新路徑
在監(jiān)管科學下,監(jiān)管部門將以患者為中心,以產品為監(jiān)管主線,基于風險的生產場地選擇模型對藥品質量合規(guī)風險進行監(jiān)管。根據(jù)新版《藥品管理法》,上市許可持有人(MAH)的責任主體將會進一步明確,接受全生命周期監(jiān)管。MAH在釋放藥企研發(fā)活力的同時,也引發(fā)了委托第三方管理的風險。
張科之結合國家藥監(jiān)局對MAH監(jiān)管最新政策,針對供應商的選擇、考核和管理提出了自己的理解。“在新的監(jiān)管模式下,MAH必須先解放思想,弱化‘認證’‘應試’思維,將質量合規(guī)戰(zhàn)略引入到研發(fā)和生產環(huán)節(jié)中,在技術創(chuàng)新和管理上持續(xù)投入,確保產品的質量合規(guī)性。”
從2017年起,原國家食品藥品監(jiān)督管理總局(CFDA)正式加入了國際人用藥品注冊技術協(xié)調會(ICH)。張科之認為,加入ICH意味著中國的藥品監(jiān)管部門、制藥行業(yè)和研發(fā)機構將逐步轉化和實施國際最高技術標準和指南,并積極參與規(guī)則制定,將推動國際創(chuàng)新藥品早日進入中國市場,滿足臨床用藥需求,同時提升國內制藥產業(yè)創(chuàng)新能力和國際競爭力。
在ICH并軌進程中,藥企將面臨與國際質量標準的升級壓力和外國藥企加速進入中國的市場競爭沖擊,還要適應“走出去”布局國際市場戰(zhàn)略的挑戰(zhàn)。ICH帶給企業(yè)的挑戰(zhàn),首要的也是質量合規(guī)。
基于FDA對28360個藥品現(xiàn)場檢查的大數(shù)據(jù)分析,張科之指出,在接受FDA檢查后,全球藥企需要整改的比例為53.6%,被警告的比例是6.5%,而國內企業(yè)的整改和被警告比例分別為68.5%和11.7%,質量合規(guī)狀態(tài)較全球藥企水平差;被FDA警告后,全球藥企的整改通過率為35.7%,耗時平均1.6年,而國內企業(yè)的整改通過率低于14%,耗時超過2.2年,質量合規(guī)應對能力差于全球平均水平。隨著ICH的并軌,國內藥企將面臨更嚴峻的質量合規(guī)挑戰(zhàn)。
圖1 2008-2020年FDA對28360個藥品現(xiàn)場檢查匯總
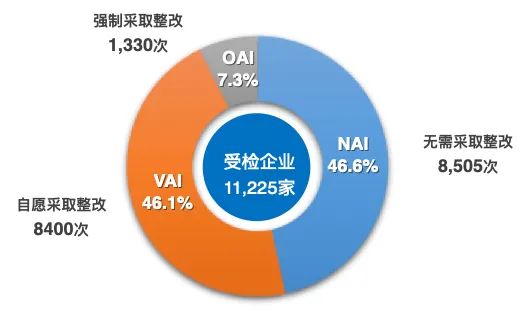
有11225家企業(yè)接受現(xiàn)場檢查的頻率≤5次,共18235次檢查
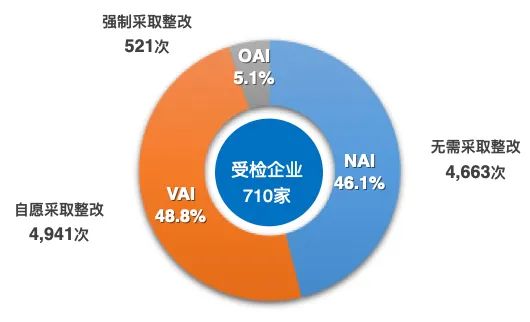
有710家企業(yè)接受現(xiàn)場檢查的頻率>5次,共10125次檢查
降價壓力加速生產模式變革
自2018年后,國家相繼推出“4+7”和集中采購政策,平均降價幅度超過50%,單品種降價最高達97%,目前化藥已經有218個完成采購,占醫(yī)保目錄的17%以上。國家希望通過“帶量采購、以量換價”模式惠及患者,讓通過一致性評價且生產效率高的產品確保優(yōu)先納入采購對象。在集采和談判中,外國藥企也紛紛加入降價的隊伍中,比如,賽諾菲的氯吡格雷片降價幅度為70%,艾伯維的修美樂降價幅度更是超過83%。
張科之指出,在全球范圍內藥品是一個充分競爭的商品。以阿托伐他汀鈣片為例,在2015年專利失效后,價格從2.13美元降到0.22美元,降價幅度達到90%。除了來自專利有效期的挑戰(zhàn)外,藥品還面臨同類產品競爭的壓力,根據(jù)美國藥品研究與制造商協(xié)會(PhRMA)統(tǒng)計數(shù)據(jù),一個原研藥上市2年就會有同類產品上市,經受降價的挑戰(zhàn),比如吉利德的HCV藥物從2013到2018年期間降價83%。
為了應對降價壓力,張科之認為,國內藥企將會在工藝科學上面臨革命性改變,變革工藝效率,確保有效降低生產成本。以默沙東Januvia (捷諾維)為例,科學家在工藝上做了革命性改進,API的成本降低了70%,產生的廢料量減少了80%,顯著地改善了產品的降價空間。除此之外,企業(yè)應由粗放式經營變?yōu)榫毣洜I管理,比如增加生產自動化、數(shù)字化管理等,不是簡單的仿制和跟進創(chuàng)新,而是變革生產效率。
張科之指出,應對價格和成本帶來的市場挑戰(zhàn),唯有技術創(chuàng)新永遠是最有力的保障,監(jiān)管層面正在由準入資格管理向質量與效率體系管理轉移,支付端激勵、引導和倒逼企業(yè)由銷售為導向轉向高質量、低成本的精細管理模式也加速了行業(yè)優(yōu)勝劣汰。
四川省醫(yī)藥保化品質量管理協(xié)會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業(yè)擬新任質量
各相關企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質量管理協(xié)會召開第七
四川省醫(yī)藥保化品質量管理協(xié)會第七..“兩新聯(lián)萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規(guī)定精神專題會議
2025年4月22日,協(xié)會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..