設計審核概念與益處
設計審核是貫穿于制造系統的整個生命周期中,對規范、設計、設計開發和持續改進變更進行有計劃的和系統的評審。
?必須應用QbD質量源于設計的概念,以確保質量屬性和要求在形成特性說明和設計過程中被設計。設計和相關的可接受標準的關鍵方面要記錄。
?確保生產系統適合其用途,不僅僅依賴于安裝后的查證,還要通過貫穿整個系統生命周期里的計劃和設計審核與確認來完成。
設計審核的作用和益處:
?保證所提出的設計內容能夠符合URS中所規定的要求;
?保證所提出的設計意見能夠最大程度降低對產品質量/患者安全性的風險;
?保證設計健全并能可靠運行,而且其性能情況可以被通過文件記錄下來;
?保證設計充分遵循現行法規指南(FDA、EMA、NMPA、PIC/S/、WHO等)要求;
?保證節省項目生命周期綜合費用(通過價值工程審核)。
設計審核位置
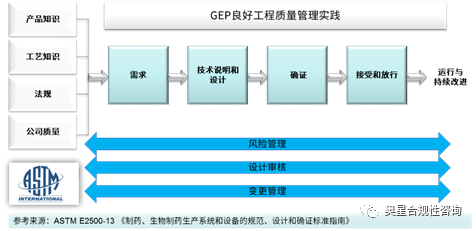
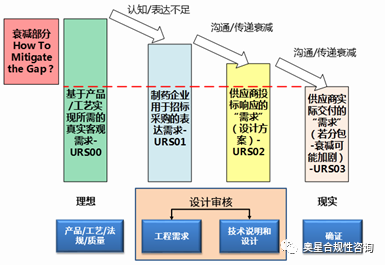
結合ASTM E2500-13及需求傳遞衰減模型,設計審核處在“理想”(符合預定用途的虛設狀態)與“現實”(確證交付的實物狀態)之間,也處在制藥企業(需求)與供應商(技術說明與設計)的過渡階段,起到非常重要的承上啟下作用,如果設計審核這座橋梁不能架設完成,那么“理想”和“現實”將會相去甚遠。
設計審核流程
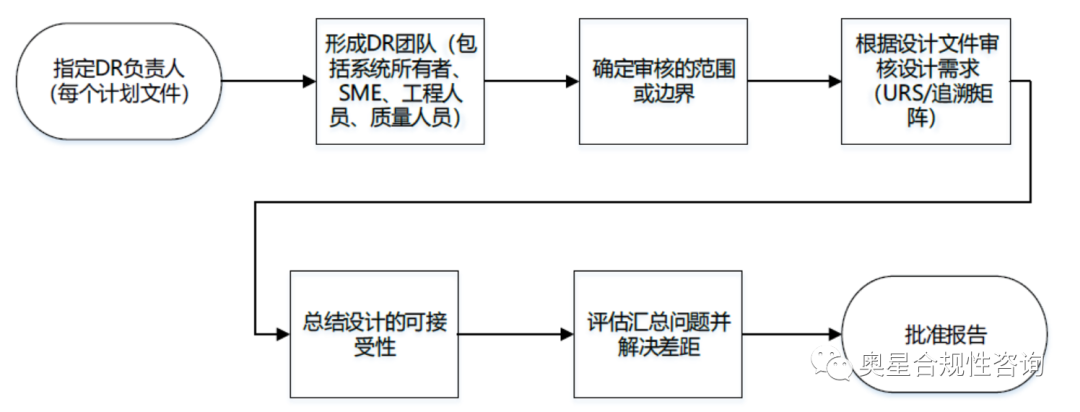
參考來源:ISPE C&Q第二版
設計審核要點
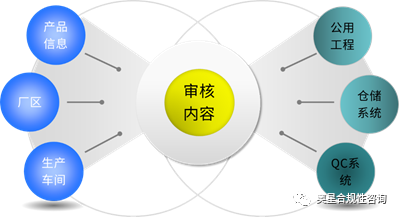
如下從產品信息、廠區、生產車間、公用工程、倉儲系統、QC系統六個方面進行設計審核要點闡述(包括不限于所列信息)。
產品信息
單一產品,還是多種產品?
產品的劑型、批量、年產量等。
產品的預期用途。產品工藝:口服、最終滅菌、非最終滅菌?
產品是否具有危害,如抗生素、激素、細胞抑制劑、卡介苗和結核菌素等。應該結合產品的危害性水平,如SDS中有關數據來進行考慮。
是否有需處理的危害產品的清單?
是否生產任何非藥品?
生產是階段性生產還是連續生產?主要控制策略如何?
涉及生物安全的產品,是否對生產品種的生物安全進行評估?
廠區
現場位置:風向、氣候對廠房排布的影響;現場應避免外部環境或對其他附近活動造成的污染。
總布局:各單體建筑均在其功能區內有序合理, 避免分期建設時破壞原功能分區;行政辦公用房應設置在非生產區;生產車間及與生產有關的輔助用室應布置在生產區內;產生有害物質的建筑(部位) 與環境質量較高要求的有較高潔凈要求的建筑(部位) 應有適當的間距或分隔。
廠區內各種設施的合理布置,實現防止或減少廢氣、廢水、噪聲及固體廢物對廠外環境的影響。
廠區和廠房內人物流走向應合理,不得相互妨礙。
消防通道和緊急集合點。
管線設置:污水管網、雨水管網、消防管網、動力管網、通信管線等的設置應配合廠區布局和未來規劃的要求。
蟲害控制措施:廠區應有有效措施防止昆蟲或其他動物進入措施,措施的設置應結合藥品具體的工藝和物料特點。
工廠餐廳的設置。
潔凈廠房位置:應在環境清潔、人流和物流不穿越或少穿越的地段;應遠離廠區內交通頻繁道路;潔凈廠房盡量遠離對大氣污染較重的設施。
綠化帶:潔凈廠房周圍應不種植產生粉塵、花絮等對大氣有不良影響的植物。
生產車間
工藝布局:應按照生產流程要求做到布置合理、緊湊,有利于生產操作。還應考慮工藝區的可視度。
潔凈區布局:空氣潔凈度相同的房間或區域相對集中;空氣潔凈度高的房間面積合理布置;不同空氣潔凈度房間之間相互聯系應有防止污染措施,如氣閘室或傳遞窗等。
關鍵流型:人流、物流、廢物流等途徑,應避免不同品種藥品的成分相互干擾、污染,或是因不恰當的流向,讓潔凈級別低的生產區域的污染物傳入潔凈級別高的生產區域而造成污染。
操作空間:操作間是否有足夠的面積和空間,應避免因場地擁擠而造成操作失誤的風險。
無菌產品:設計時應考慮以下方面:高風險操作區(如無菌配制和灌裝)應采取嵌入式設計,在其外部設置保護區域,人員經過更衣控制,物料和部件則需要經過必要的淸潔滅菌后方可進入無菌操作區域,使外界對無菌環境的影響降到最低。
蟲害控制:車間布局是否包含蟲害控制設施。
信息化與自動化:審核信息化與自動化策略,符合計算機化系統、電子記錄&電子簽名及數據完整性相關法規指南要求。
清洗、滅菌與滅活:審核清洗、滅菌、滅活策略是否能夠降低和控制交叉污染及生物安全風險;個人防護設備(PPE)的再利用進行了控制,以充分保護其免受再污染,并防止其成為交叉污染的來源?
其他:是否有足夠的值班室、人員休息及更衣場所?是否有合理的維修間?
公用工程
HVAC與潔凈室:潔凈級別/溫度/濕度/氣流方向/緩沖間/壓差/新風、送風及回風/墻板、地面及門窗/照明/通訊設施/室內管線、地漏/廠房清潔消毒方式。
潔凈公用系統(水與純蒸汽系統):是否滿足工藝與產能要求?是否在用水點對各標準的工藝用水進行監控,如理化指標,總微生物數或其他微生物限度?飲用水的來源和標準?構造材質,管道坡度,死角控制,系統排空能力微生物污染控制,儲罐騰空次數,循環溫度,回水流速,呼吸器與0.22μm過濾器,儀表監測控制與校準,清洗、消毒和滅菌方式等是否符合要求?
其他公用設施系統:工藝用氣系統,儀表用氣系統,真空系統,供電系統,制冷系統,蒸汽系統,廢物處理和工藝排水系統,樓宇管理系統,環境監視系統,消防系統,視頻監視系統,門禁控制系統等滿足產能、工藝、安全、合規、數據完整性、能源節約等要求。
倉儲系統
倉儲區應有足夠的面積和空間,安置設施設備、存儲物料和產品、便于人員操作,與生產規模相適應,滿足倉儲容量需求。
倉儲設計需要考慮減少存儲物料和人員的運動距離,盡可能做到人流、物流分開。
倉儲區要保持清潔和干燥,并有足夠的空間,滿足分區存放。并應區分待驗品區、合格品區、不合格品區。不合格產品、回收產品以及退貨藥品單獨、隔離存放。
倉儲區應設有溫、濕度監測、控制儀器儀表,并對照明、通風等條件進行控制。
倉儲區應設取樣室,其潔凈程度應同生產環境相同。取樣時應有防止污染以及交叉污染的措施。
儲區應設有防蟲、防鼠、防鳥類設施;還應準備防火、防水措施;接收、發放物料應有措施保護產品、物料免受不良氣候的影響;不設置地溝、地漏,以免細菌滋生。
對于頭孢菌素類、青霉素類、激素類、放射性藥物、高生物安全風險產品應單獨放置,避免交叉污染。
對于使用自動化倉儲管理系統WMS、高架立體庫倉庫控制系統WCS、溫濕度調控系統BMS、環境監視系統EMS等,審核信息化與自動化策略,符合計算機化系統、電子記錄&電子簽名及數據完整性相關法規指南要求。
QC系統
質量控制實驗室通常應當與生產區分開。
實驗室的區域是否足夠,生物檢定、微生物和放射性同位素的實驗室還應當彼此分開。
實驗室的設計應當確保其適用于預定的用途,并能夠避免混淆和交叉污染,應當有足夠的區域用于樣品處置、留樣和穩定性考察樣品的存放以及記錄的保存。
必要時設置專門的儀器室,使靈敏度高的儀器免受靜電、震動、潮濕或其他外界因素的干擾。
處理生物樣品或放射性樣品等特殊物品的實驗室應當符合國家的有關要求。
實驗動物房應當與其他區域嚴格分開,其設計、建造應當符合國家有關規定,并設有獨立的空氣處理設施以及動物的專用通道。
微生物實驗室應包括相應的潔凈區域和生物安全控制區域,同時應根據實驗目的,在時間或空間上有效分隔不相容的實驗活動。
應急沖淋器和應急眼睛沖洗器:對于經常使用強酸強堿有化學品燒傷危險的實驗室建議在出口就近處設置;對于單走道兩面布置的質量控制區,可在走廊的合適位置設置。
總結
設計審核必須由具備先驗知識和經驗的SME專業團隊來完成,其核心是基于對產品和工藝的理解,避免污染、交叉污染、混淆和差錯,保證法規符合性,降低產品質量風險及職業健康風險,并利于后期的使用與維護,達到項目生命周期費用投入節省與平衡的綜合目的。
主要參考文獻:
1.中國,藥品生產質量管理規范(2010年修訂)及相關附錄
2.歐盟藥事法規第四卷 藥品生產質量管理規范及相關附錄
3.FDAPart 210,Part211 ,Part11
4.ASTME2500-2013
5.FDA行業指南:預防非青霉素β-內酰胺藥物交叉污染的CGMP框架, 2003年4月
6.GBZ1-2010工業企業設計衛生標準
7.GB50187-2012工業企業平面設計規范
8.GB50073-2013 潔凈廠房設計規范
9.GB51133-2015 醫藥工業環境保護設計規范
10.GB50457-2019 醫藥工業潔凈廠房設計標準
11.GBZT194-2007工作場所防止職業中毒衛生工程防護措施規范
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..