去年9月,綜合審評實施后,新藥批準卷宗提供的所涉信息將會有所減少的報道,引起各界的廣泛關注。近日,FDA新藥辦公室主任Peter Stein醫生在接受采訪時,糾正了當時的不準確傳達。
FDA新藥辦公室(Office of New Drugs,OND)主任Peter Stein醫生,日前在FDA在白橡樹園區接受業界知名的專業媒體Regulatory Focus的采訪。在采訪中,Stein主任討論了近幾個月來,FDA受到的一些批評。這些批評,涉及藥品批準速度,以及可能存在批準標準降低等。同時,Stein醫生還針對去年12月獲批的用于治療杜氏肌營養不良癥的Vyondys 53(golodirsen)注射劑,闡述了相關問題。Stein醫生還對一些問題做出回應,包括是否可以采取更多措施,加快確認性臨床試驗,加快批準速度。以及在改進透明度,在新藥辦公室重組方面,所采取進一步舉措。

▲FDA新藥辦公室主任Peter Stein醫生(圖片來源:FDA官網)
問:最近幾個月,有一些報道,涉及到FDA如何依據較少的臨床證據,批準了更多藥品;以及允許在沒有對照組的情況下,開展更多的臨床試驗,作為新的證據。您是否認同相關報道的觀點?在FDA內部,對這種明顯轉變,是否有所擔憂?
Stein醫生:我認為,真正的答案在于,大家應該考慮到,我們如何針對所面臨的實際情況,正在監管的藥品,以及提交批準申請的藥品,來做出決策。簡言之,答案是“否”,大家并沒有考慮到上述的各種具體情況。我認為, 我們的標準,并沒有變化。當大家審視類似申請時,沒有證據表明,與幾十年來我們一直的要求相比,現在有什么不同。盡管一些工具有些變化,但是,當您審視能夠符合我們標準的要求時,我認為,并沒有改變。如果大家回顧20年前,并與過去幾年的情況相比較,就會看到,我們當時著手應對常見慢性病,諸如慢阻肺(COPD)、哮喘、糖尿病、高血壓和偏頭痛的藥品。如果大家回顧過去幾年,仍然看看一些治療慢性病的藥品,但即便在這些領域,即便之前有藥可用,也往往存在一些亞組和人群,存在治療不足(undertreated)的情況。而我們現在看到的是,罕見病治療藥物,有了大幅度增長。
這是實實在在的改變,非常顯著的改變,在癌癥治療藥物數量方面,尤其是針對我們已經認定了分子機制的癌癥亞型和罕見癌癥的藥物,今非昔比。但是,大家會問,對于這些類型的藥物,是否需要視具體情況,具體考慮,我們是否使用了更多的單臂、歷史對照試驗?確實如此,那是因為,我們正在著手應對更為罕見的疾病。
如果大家看看20年前的同類藥物,比較不同時期的同類藥物,是否有所不同?我的看法,是否定的。在針對這些類型藥物的相關程序適用的情況下,我們現在接受較小的程序,更多的單臂試驗。如果大家將蘋果與蘋果相比較,而不是將蘋果與橘子相比較,那么我認為,從做出批準決定的批準卷宗,大家可以看出,并不存在實質差異。

圖片來源:Pixabay
舉例來講,如果對于一種分子機制已經明晰的罕見癌癥,對于以相關分子機制為靶向的藥物,我們已經獲得顯著的響應(response),與歷史對照中發現的響應截然不同。針對這類藥物,如果具有非常有說服力和令人信服的實例,對患者有意義和非常重要的獲益,就沒有進行隨機化試驗的必要。
重要的是,大家需要認識到,我們一直在應對不確定性。對于罕見病,大家所關注的,是進行性、嚴重和最終足以致命的疾病;對于這樣的疾病,患者和醫生愿意接受更多不確定性。在亟需治療的患者面前,我們究竟可以接受多少不確定性?這始終需要加以平衡。我們不希望帶給大家不切實際的希望,我們所希望的,是設法找到答案,同時接受一些不確定性。當然,在這樣的情況下,我認為,這樣的做法,符合我們的法規。
問:對于不確定性,在批準Sarepta公司的杜氏肌營養不良癥治療藥物golodirsen時,引起了一些爭議。在此,您是否愿意闡述相關的完全回應函(complete release letter)中提出的一些問題?
Stein醫生:我將會在可以公開下載的在線信函中詳細闡述。我認為,必須指出: 我們并不排斥分歧。通過求同存異,允許和合理接受科學觀點上的差異,有助于做出盡可能最好的決定,但最終必須做出決策。相關的審評部門做出了一個決定,作為科學家,我尊重(負責審評的新藥辦公室藥品審評部負責人)Ellis Unger醫生所做出的不同的決定;然后,我審查了這一決定,并做出不同的決定。
對于這些決定,我們各自都有具體的理由。當大家審視罕見病和亟需患者時,相關的數據集,極具挑戰性。

圖片來源:Pixabay
在此,我要講的是,對我來說,重要的是,這家公司實際上將能夠取得進展,開展研究。正如我在相關的回應函中所指出的那樣,Sarepta公司正在開展研究,在患者招募方面,進展非常順利。對我而言,作為整個范式的一部分,我們希望在合理的時間內,盡快地獲得更為穩健可靠的臨床數據,來驗證和確認,我們確實看到了大家所希望看到的獲益。對我來說,了解到相關的臨床試驗正在進行,并且有足夠的把握度評價相關問題,這些很重要。接受不確定性,并不等同于不加約束地允許不確定性。我們接受某些不確定性,但是我們希望看到正在進行的試驗,使得我們能夠確認,確實有獲益。大家可能還看到,我曾要求Sarepta公司,確認他們了解,相關的臨床試驗將尋求什么樣的獲益;如果我們不能認定相關的獲益,那么,相關藥品應予退市。
這些很重要,但這并非沒有約束、無休無止的決定。隨著相關進展,我們將獲得更多信息,以便做出更為細致的決策。
問:FDA能夠做些什么,來確保獲得藥品加速批準的公司,按時完成相關的確認性研究?對于超出確認試性臨床試驗期限的情況,您是否認為,會對相關醫藥公司處以罰款?
Stein醫生:我們現在正在加以研究,這很重要。對于golodirsen這一具體藥物,這確實很重要。 我認為這應該成為規則,我們應該就該盡力而為,確保能夠提出一個可行、具備可操作性的試驗,在合理的時間內,獲得相關信息。但知易行難,有時,會比我們所能夠想象的更具挑戰性,耗時更長。
在癌癥治療藥物領域,已有可資借鑒的經驗,不乏在合理的時間限內,顯示出相當高的確認率的實例。我們是否能夠再做些什么?我們正在研究這一問題,以便優化與申辦方的互動,切實可行地開展的各種試驗,并且,我們將監控這些試驗。我想強調,我們不希望批準一個藥品之后,沒有我們需要的后續數據。
我無法推測是否會予以罰款,但我們將研究現有的工具,了解如何與公司更好地合作,以開展研究。我認為,最好從一個能夠實際解決問題的位置開始,這樣的位置應該可行,能夠保證與公司密切合作,確保相關的臨床試驗設計,可以回答我們所提出的問題。這將會是一個更好的過程,我們能夠仔細監控,確保相關的醫藥公司能夠履行承諾,開展確認性臨床試驗研究。

圖片來源:Pixabay
問:您認為,FDA在哪些方面可以更加透明?去年秋天,在RAPS Convergence大會上,您在演講中談到,利益攸關方如何從FDA公布的批準卷宗(approval package)中,檢索某些數據。根據一項新的計劃,獲取某些信息,將涉及到《信息自由法案》(the Freedom of Information Act FOIA)。這項新計劃進展如何?
Stein醫生:我認為,我在那次大會上的講話中,我誤解了這個問題。當時我所講的,并不正確。在以前的批準卷宗中的所有內容,都將在新的卷宗中提供。仍然有可能像現在這樣,依據《信息自由法案》進行補充,但這些卷宗的篇幅會變小。 原因在于,我們確實減少了重復,但是該卷宗的所有要素,在批準卷宗中都將會所體現,予以提供。因此,對于希望查詢數據,或研究我們的分析和決策的用戶來講,可用的內容,將不會有任何顯著差別。

圖片來源:Pixabay
新的綜合審評另外一個部分,對問題進行重點討論,并提供全面的評價,并附有附錄,其中有很多圖表和數字,這些圖片和數字,不如我們放在第一部分中的那么重要。大家所檢索的內容將可用,我認為,在去年的會議上,我并沒有傳達準確。的確,相關的篇幅,確實更少,原因在于,我們已經消除對流程設計的每個回顧,不再事無巨細地包攬,加倍提高了效率,刪繁就簡,保留了大家之前通過批準卷宗檢索的信息。
我們有團隊開展了綜合審評,我們完成了一些工作,這是一項正在進行中的工作。我們正在研究他們貫徹落實我們的目標情況,即更清楚地了解,關鍵問題究竟是什么。我們以及患者和醫生,將有更大的清晰度,了解我們對每個應用程序的考量。我認為,在綜合審評中,我們將會更加透明,將預先明確問題,并標記出討論有效性,或是安全性問題的相應部分。我認為,將會更清楚。新的流程,包括更多的團隊互動,以及與負責處理這些問題的管理層和工作組的討論。我認為,大家將會發現,大家所看到的內容,將能夠對我們的考量和分析,有更為深入的了解,而不是僅僅是單個的審評。

圖片來源:Pixabay
我要強調的一件事,是 我們接受不同意見。 我認為, 在我們的流程中,我們之間存在站得住腳的科學上的不同意見,這確實很重要。而這個新模板,絕不會扼殺這一點。我們中間,并不是所有人都同意結論,能夠將不同的意見擺到桌面上,然后我們確保團隊能夠解決分歧。我們必須做出決定和評價,但是我們希望,能夠接受意見分歧。
問:您能否談談新藥辦公室(OND)重組對其自身有何幫助?
Stein醫生:我確實希望退一步說,我們正在實施的現代化計劃,實際上不只是重組。我們正在研究很多流程,例如新藥批準(NDA)和生物制品許可批準(BLA)申請審評(集成審評)。這是一項持續的工作流程,我們正在研究,我們如何進行30天的新藥臨床研究申請(IND)默示許可。我們正在研究上市后工作流程,將更多信息放入IT系統,以及有關人才和專業發展的工作流程。
相關重組的目的,實際上是為了使新藥辦公室(OND)在治療上更加統一,并使部門的規模更合適。因此,當我就任新藥辦公室主任時,確實有一些部門,非常龐大,職責范圍很廣,通常由一名主任和副主任來領導(這些部門);但實際上,是由小型化的領導層負責,這種小馬拉大車的方式,這本身就是挑戰。因此,我們希望調整部門規模,使其大小得當。但更為重要的是,我們希望,將多個部門合并,更多地專注于相關的疾病。最好的例子是DGIEP(Division of Gastroenterology and Inborn Errors Products,胃腸病學與先天缺陷產品部門),這樣的部門,僅僅是名稱的羅列,沒有多少實質意義。因此,我們現在將有一個新的罕見病與醫學遺傳學部門,這個部門將會納入關注先天缺陷疾病的團隊,而我們的罕見病小組,將會設立胃腸病和肝病部門。
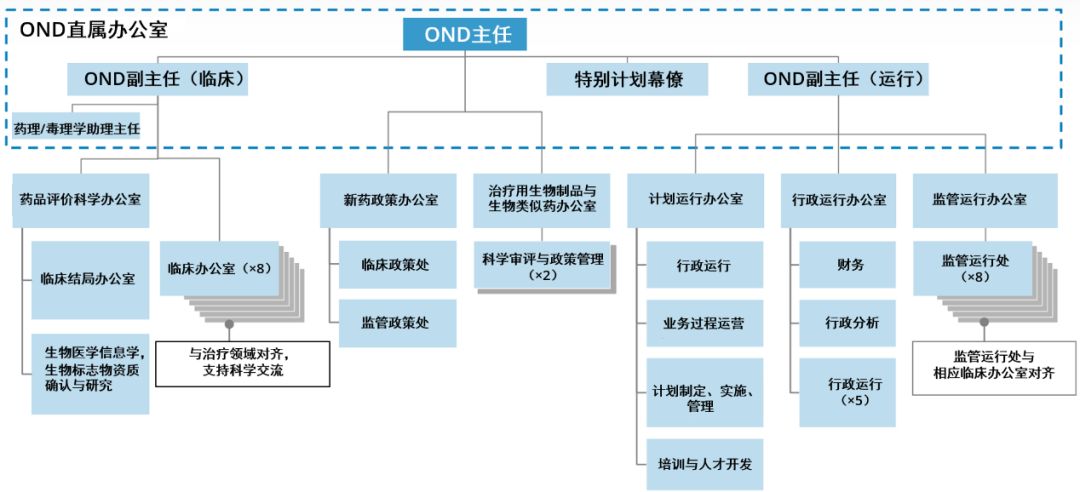
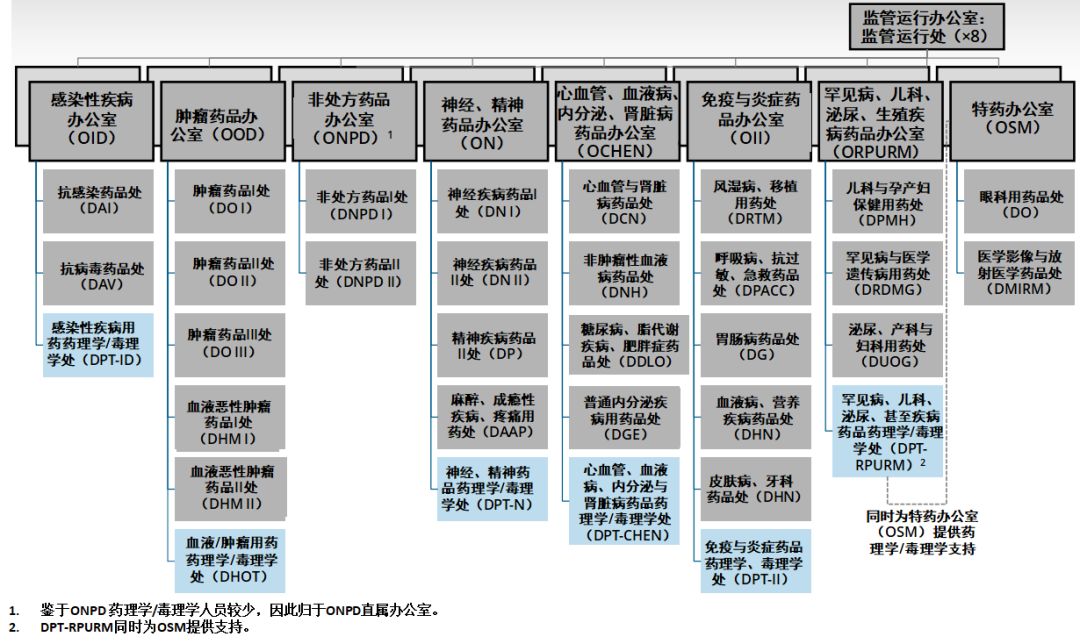
圖片來源:參考資料[11],藥明康德內容團隊制圖
對于大型部門,例如神經系統疾病藥品部門,我們將其一分為二,使得領導層對監管工作量的分配更為合理,目的是使領導層能夠更具戰略性,更注重外部,能夠領導并滿足其治療領域的廣泛需求。不乏成功的例子,例如腫瘤學卓越中心(Oncology Center of Excellence,OCE)。
將多個辦公室整合在一起的理念,能夠在治療領域上,更加統一。我們有炎癥和免疫學辦公室,實際上,涉及的所有相關藥物,都可以跨部門。設立針對皮膚病、肺病和風濕病藥物的辦公室,同一辦公室旗下的所有這三個部門,可以加強醫學審評與管理計劃管理人員之間的協作與互動。我希望通過這種方式,可以產生更多的對話,進一步促進藥物開發,提高我們的技能,改進相關的藥品監管。
所有辦公室的藥理學/毒理學部門,都將促進人員流動,因此在審評藥品臨床試驗申請(IND)時,可以獲得更為廣泛的經驗,加深理解,擴展視野。
現在還處于初期,但是我認為,增強協作和互動,將使我們能夠更好地完成工作。我們將滿懷希望,見證未來幾年的發展。
免責聲明:本文僅作信息交流之目的,文中觀點不代表藥明康德立場,亦不代表藥明康德支持或反對文中觀點。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..