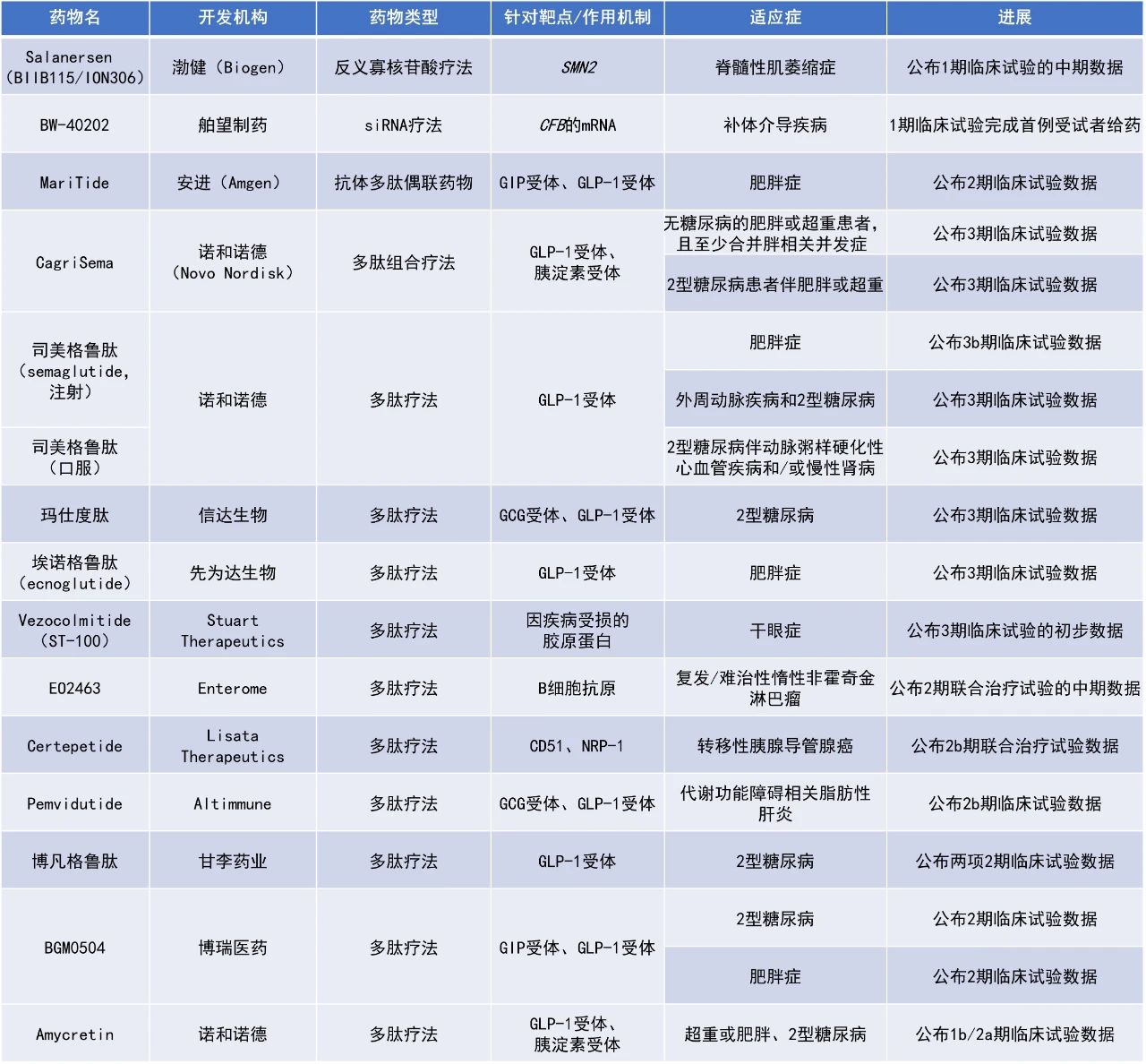
EO2463:公布2期聯合治療試驗的中期數據 Enterome公司公布了其基于腫瘤肽的免疫療法EO2463與來那度胺和利妥昔單抗聯用治療惰性NHL的積極2期臨床結果。EO2463由4種模擬B細胞腫瘤相關抗原CD20、CD22、CD37和CD268(BAFF受體)的多肽以及輔助性的UCP2肽組成,能夠激活抗腫瘤免疫反應,清除癌變B細胞。 此次公布的結果顯示,EO2463聯合來那度胺和利妥昔單抗治療后,60%(12/20)的患者達到了CR。該組合療法在濾泡性淋巴瘤和邊緣區淋巴瘤患者中耐受性良好。此外,該研究中觀察到的CR率高于歷史數據中來那度胺聯用利妥昔單抗治療所預期的水平。 Certepetide:公布2b期聯合治療試驗數據 Lisata Therapeutics公司與澳大利亞胃腸試驗組(AGITG)、悉尼大學NHMRC臨床試驗中心公布了2b期臨床試驗ASCEND的初步結果。該試驗評估了Lisata公司的在研環肽療法certepetide聯合標準治療化療用于治療轉移性胰腺導管腺癌患者的效果。Certepetide旨在激活一種腫瘤特異性的轉運系統,使與之聯合使用的全身性抗癌藥物能夠更有效地穿透腫瘤并在腫瘤內蓄積。此外,certepetide還被證明可以調節腫瘤微環境,使腫瘤對免疫療法更加敏感。 該研究包括兩個隊列,隊列A的患者在吉西他濱輸注結束后、白蛋白紫杉醇輸注開始前,靜脈推注certepetide 3.2 mg/kg。隊列B的患者在隊列A治療方案的基礎上,在首次給藥4小時后追加一次certepetide或安慰劑。此前公布的隊列A的結果顯示,患者的總生存期呈現出積極趨勢,并且有4例患者達到CR,而安慰劑組未觀察到任何CR病例。此次公布的隊列B的初步數據顯示,certepetide組的6個月無進展生存率為60.8%,安慰劑組為25%;兩組的中位無進展生存期分別為7.5個月和4.7個月;ORR分別為45.2%和19%;中位總生存期分別為10.32個月和9.23個月。隊列A和隊列B的數據比較表明,在標準化療中加入兩劑certepetide(隊列B方案)使mPDAC患者的無進展生存期和ORR都獲得了有臨床意義的改善。 Pemvidutide:公布2b期臨床試驗數據 Altimmune公司公布了pemvidutide治療MASLD的2b期試驗的積極結果。Pemvidutide是一種GLP-1/胰高血糖素雙重受體激動劑,目前正在開發用于治療MASH和肥胖癥。該研究中,212名經活檢證實的MASH和纖維化F2/F3期伴或不伴糖尿病的受試者按1:2:2的比例被隨機分配接受pemvidutide(1.2 mg或1.8 mg)或安慰劑,持續24周。 此次公布的結果顯示,在意向治療(ITT)人群分析中,試驗達到了其主要終點。在24周時,pemvidutide高劑量組患者中有59.1%達到了MASH緩解,且未出現纖維化的惡化;34.5%的受試者出現了纖維化改善,且沒有發生MASH的加重。基于人工智能(AI)的補充分析表明,接受pemvidutide治療24周后,患者的肝纖維化改善具有統計學意義。此外,pemvidutide高劑量組患者在24周時的平均減重幅度達到6.2%,且體重仍在持續下降,尚未出現平臺期。安全性方面,pemvidutide表現出潛在“best-in-class”的耐受性,因不良事件而停藥的比例低于1%。 Vezocolmitide(ST-100):公布3期臨床試驗的初步數據 Stuart Therapeutics公司公布了其3期臨床試驗的初步結果,該試驗評估了ST-100滴眼液治療干眼癥(DED)的療效。ST-100是一種膠原模擬肽類藥物,其獨特機制可通過修復眼部受損的膠原蛋白來恢復眼表穩態,從而減輕DED的影響。此次公布的結果顯示,ST-100治療起效迅速,在治療2-4天內就能緩解患者的體征和癥狀。其中,ST-100治療一周后熒光素染色評分(用于量化眼表上皮細胞損傷程度)的改善幅度超過了現有已批準的DED治療藥物/產品的公開報告數據。該研究結果將有助于指導ST-100的第二項3期研究的設計。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..