轉自:CDE 排版:水晶
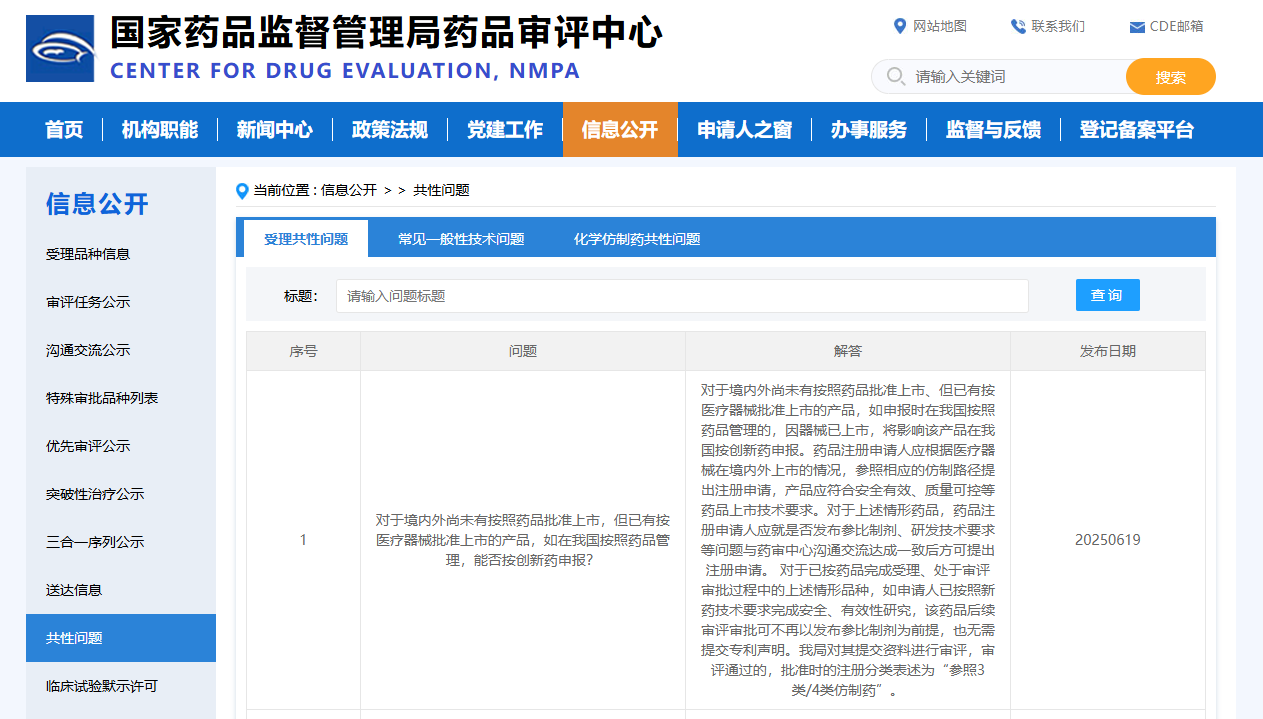
Q:對于境內外尚未有按照藥品批準上市,但已有按醫療器械批準上市的產品,如在我國按照藥品管理,能否按創新藥申報?
A:對于境內外尚未有按照藥品批準上市、但已有按醫療器械批準上市的產品,如申報時在我國按照藥品管理的,因器械已上市,將影響該產品在我國按創新藥申報。藥品注冊申請人應根據醫療器械在境內外上市的情況,參照相應的仿制路徑提出注冊申請,產品應符合安全有效、質量可控等藥品上市技術要求。
對于上述情形藥品,藥品注冊申請人應就是否發布參比制劑、研發技術要求等問題與藥審中心溝通交流達成一致后方可提出注冊申請。對于已按藥品完成受理、處于審評審批過程中的上述情形品種,如申請人已按照新藥技術要求完成安全、有效性研究,該藥品后續審評審批可不再以發布參比制劑為前提,也無需提交專利聲明。我局對其提交資料進行審評,審評通過的,批準時的注冊分類表述為“參照3類/4類仿制藥”。
關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..學習八項規定 增強警示教育
近日,四川省醫藥保化品質量管理協..《持續合規 提質創新》 2025年度四川省
2025年3月24至3月27日,四川省醫藥..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..