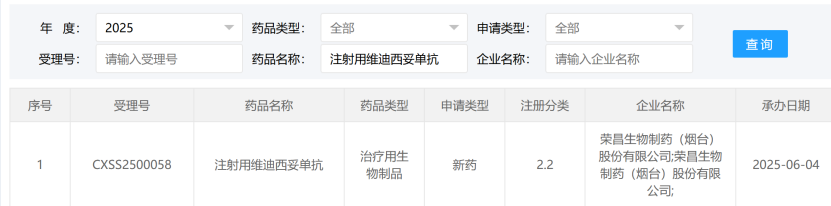
6月6日,阿斯利康宣布,阿可替尼與維奈克拉(聯合或不聯合奧妥珠單抗)的固定療程方案已在歐盟獲得批準,用于治療先前未接受治療的慢性淋巴細胞白血病(CLL)成年患者。 據悉,該批準基于關鍵Ⅲ期AMPLIFY研究結果。這是一項隨機、全球、多中心、開放標簽的Ⅲ期臨床試驗,旨在評估阿可替尼+維奈克拉±奧妥珠單抗對比研究者選擇的化學免疫療法,用于既往未經治療且無del(17p)或TP53突變的CLL成年患者的療效和安全性。研究的主要終點是由獨立審查委員會(IRC)評估的阿可替尼+維奈克拉組的PFS。 6月5日,三生國健宣布,其自主創新研發的重組抗IL-1β人源化單克隆抗體注射液SSGJ-613 急性痛風性關節炎適應癥已向NMPA遞交上市申請并獲受理。新聞稿指出,目前我國尚無IL-1β同靶點藥物上市。 主要分析結果顯示,SSGJ-613在急性痛風性關節炎疼痛緩解和預防復發方面達到雙主要療效終點。其在緩解急性痛風性關節炎受試者的急性疼痛方面與陽性對照藥物復方倍他米松注射液的作用相當,此外在預防急性痛風復發方面顯著優于陽性對照藥物。 同時,SSGJ-613表現出良好的安全性和耐受性,常見不良事件均在預期范圍內,與同靶點IL-1β單抗藥物相比,未發現新的安全性信號。 據CDE官網近日公示,榮昌生物申報的注射用維迪西妥單抗新適應癥上市申請獲得受理。根據榮昌生物公開資料,本次申報上市的適應癥為治療HER2低表達乳腺癌。 截圖來源:CDE官網 公開資料顯示,維迪西妥單抗為一款HER2靶向抗體偶聯藥物(ADC),通過“精準爆破”機制,不僅能殺傷HER2高表達腫瘤細胞,還可通過“旁觀者效應”攻擊鄰近HER2低表達細胞。 該產品此前已有三個適應癥在中國獲批上市,分別適用于至少接受過2種系統化療的 HER2過表達局部晚期或轉移性胃癌患者、既往接受過含鉑化療且HER2過表達局部晚期或轉移性尿路上皮癌患者、既往曾接受過曲妥珠單抗或其生物類似藥和紫杉類藥物治療的HER2陽性存在肝轉移的晚期乳腺癌患者。AZ聯合療法首次獲批上市
國內第二款,三生國健痛風新藥國內報上市
榮昌生物ADC新適應癥申報上市
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..