百濟神州申報的1類新藥BGB-16673片兩項新的臨床試驗默示許可,擬開發治療慢性自發性蕁麻疹。公開資料顯示,BGB-16673是一種口服、靶向BTK的在研嵌合式降解激活化合物(CDAC)。
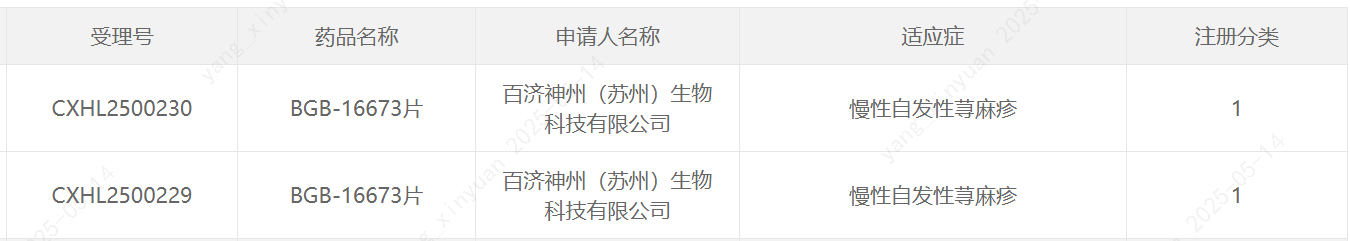
截圖來源:CDE官網
成人慢性自發性蕁麻疹(CSU)是指持續6周或更長時間的慢性蕁麻疹,導致該疾病的根本原因是內在因素而非暴露于過敏原或外部誘因,其特征是突然出現瘙癢性風團和/或深部組織腫脹 (血管性水腫,可發生在面部、喉部、手和足) 。該病影響所有年齡段人群,但最常見于20~40歲之間,女性患病率幾乎是男性的兩倍。CSU會對患者造成嚴重的情緒困擾,大多數患者睡眠不足,精神障礙的比例很高,如焦慮或抑郁,工作效率也會受到影響。
公開資料顯示,抗組胺藥通常被用于治療CSU,因為它們可以阻斷組胺受體并防止組胺的促炎作用,從而緩解瘙癢和腫脹。然而,超過50%的CSU患者在僅使用H1-抗組胺藥的情況下無法得到有效控制。BTK抑制劑可阻斷BTK級聯反應,并抑制導致瘙癢性風團和腫脹的組胺釋放,從而用于治療蕁麻疹。
根據百濟神州公開資料介紹,BGB-16673是一種口服靶向布魯頓氏酪氨酸激酶(BTK)的嵌合式降解激活化合物(CDAC),是百濟神州CDAC平臺首款在研藥物。該產品旨在誘導野生型BTK和多種突變型BTK的降解,包括出現疾病進展的患者中對BTK抑制劑產生耐藥性的BTK。該產品此前已經獲得美國FDA授予快速通道資格,用于治療復發/難治性(R/R)慢性淋巴細胞白血病或小淋巴細胞淋巴瘤(CLL/SLL)成年患者。針對CLL/SLL適應癥,BGB-16673已經進入3期臨床研究階段。
本次BGB-16673針對慢性自發性蕁麻疹獲批臨床,意味著該產品的臨床研究進程迎來新的進展。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..