1月27日,中國國家藥監局藥品審評中心(CDE)官網公示,康方生物1類新藥古莫奇單抗注射液上市申請獲得受理。公開資料顯示,這是康方生物自主研發的靶向IL-17的單克隆抗體(AK111)。康方生物在2024年年中報告中表示,古莫奇單抗針對中重度斑塊狀銀屑病(PsO)的3期臨床研究取得陽性結果,即將提交NDA申請。
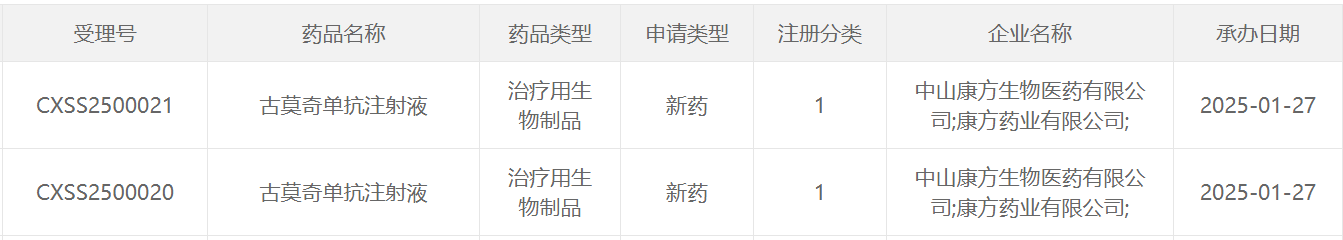 截圖來源:CDE官網
截圖來源:CDE官網
銀屑病是一種遺傳、環境協同作用的免疫介導的慢性復發性疾病,其中斑塊型銀屑病是最常見類型,約占80%。銀屑病皮疹及伴隨癥狀不僅顯著降低生活質量,對工作、社交、心理的影響及治療相關費用等也給患者造成了沉重疾病負擔。盡早啟動以生物制劑為代表的治療,及早干預疾病進程,達到治療效果是目前銀屑病患者的迫切需求。
IL-17A作為促炎細胞因子,通過多種途徑建立維持銀屑病患者表皮炎癥反應的反饋回路、促進角質形成細胞的增殖并抑制其分化、破壞皮膚屏障,在銀屑病發病機制中起到關鍵作用。古莫奇單抗是康方生物自主研發的與人IL-17A結合的IgG1單克隆抗體,特異性和高親和力結合人IL-17A,阻斷IL-17介導的信號傳導,由此發揮治療銀屑病的作用。
2024年10月,康方生物宣布,古莫奇單抗治療中重度斑塊型銀屑病的關鍵3期研究(AK111-301)繼2023年達到主要終點后,已完成研究并獲得優異的長期療效和安全性結果。AK111-301是一項在中重度斑塊型銀屑病患者中開展的隨機雙盲安慰劑對照的多中心3期研究,治療隨訪至56周。PASI是一項皮損嚴重程度及面積的綜合性評分,PASI75應答代表PASI評分較基線達到75%及以上改善,PASI90應答代表PASI評分較基線達到90%及以上改善,PASI100應答代表PASI評分較基線達到100%改善。sPGA是研究者對皮損總體外觀的整體性評分,sPGA0/1代表皮損清除或極輕微。
AK111-301研究在2023年達到主要終點,12周療效結果顯示:PASI75應答率近95%,sPGA0/1應答率近90%;PASI90應答率超80%,PASI100應答率近50%。
長期治療隨訪最終結果顯示,古莫奇單抗治療中重度斑塊型銀屑病在長期維持以及進一步改善療效方面的能力突出:治療第52周,PASI75應答率近100%,sPGA0/1應答率近90%;PASI90應答率超90%,PASI100應答率超70%。此外,停藥8周后,較第52周比較,PASI75、PASI90、sPGA0/1應答率約97%患者維持應答。
除了治療銀屑病,康方生物還正在開發古莫奇單抗治療強直性脊柱炎等其他自身免疫性疾病,該產品治療強直性脊柱炎的注冊性3期臨床研究正在開展中。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..