據藥時代統計,2015年至今,FDA共批準新藥465款,其中2018年批準數量最高,達59款;2016年批準數量最低,達22款。
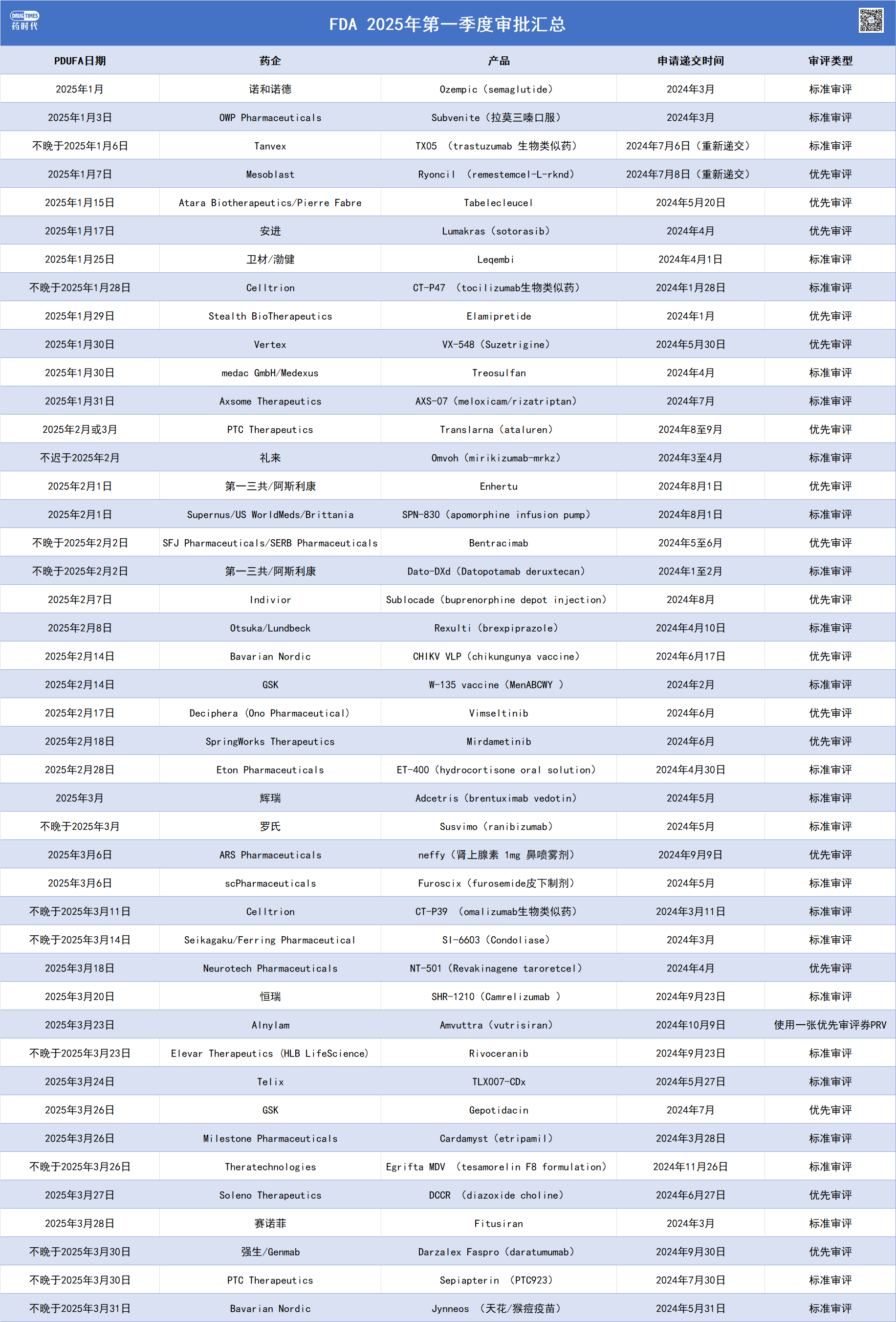
2024年,FDA藥品評價與研究中心(CDER)共批準了50款新藥,其中包括34款新分子實體和16款生物制品。從疾病領域角度分析,腫瘤(28%)依然是獲批數量最多的領域,其次是罕見病(20%),之后依次為心血管及代謝、感染、自身免疫性疾病、皮膚病、精神和神經類等疾病領域。從技術角度分析,首款mRNA疫苗、首款TCR-T細胞療法(Adaptimmune的Tecelra)、首款TIL療法(Iovance的Lifileucel)等多款里程碑進展于2024年達成。2025年,FDA將繼續加大審批力度,預計第一季度審批新藥共計44款,表格如下:
為此,知名行業媒體Biospace統計了2025年第一季度最值得期待的五項監管決定。
Leqembi(侖卡奈單抗)是人源化免疫球蛋白γ 1(IgG1)單克隆抗體,靶向聚集性可溶性(原纖維)和不溶性淀粉樣蛋白β(aβ),由Biogen與衛材合作開發的阿爾茨海默癥早期藥物。目前,兩家公司正在推動Leqembi每月一次靜脈維持治療方案的審批,預計結果將于2025年1月25日公布。現有用藥方案顯示,Leqembi為兩周一次靜脈輸注給藥,每次大約需要一個小時。而最新用藥方案,則是將Leqembi的給藥間隔延長至一個月(初步的雙周啟動階段后)。Biogen與衛材表示,新的每月維持治療方案旨在保持體內Leqembi的有效濃度,以抑制有毒原纖維,減少神經損傷和腦損傷的風險。此方案基于IIb期研究201及其開放標簽擴展研究的數據模型,以及III期Clarity AD研究和其擴展階段的數據。此外,兩家公司還在開發Leqembi的皮下注射劑型,并已開始滾動提交生物制品許可申請,預計于2026年3月獲得批準。目前,約有6,000名患者正在等待接受這種療法的初始治療。一旦解決了基礎設施和行政挑戰,這可能轉化為未來的增長動力。
阿斯利康和第一三共的Dato-DXd
適應癥:轉移性、HR陽性、HER2陰性乳腺癌
Dato-DXd是一款TROP2 ADC,由阿斯利康與第一三共共同開發。2024年初,兩家公司提交了該藥物的BLA,適用于可手術或轉移性、HR陽性且HER2陰性或低表達的乳腺癌,PDUFA日期為今年1月29日。
根據III期TROPION-Breast01研究的數據,Dato-DXd相較于化療,在降低死亡或疾病進展風險方面展現了37%的顯著優勢,這一效果被認為具有統計學意義和臨床重要性。然而,后續數據顯示,盡管Dato-DXd對無進展生存率有明顯改善,但在總生存率上未能顯著提升。
安全性方面,TROPION-Breast01研究表明Dato-DXd總體耐受良好,其不良事件概況優于傳統化療。最常見的3級或以上副作用包括中性粒細胞減少癥、疲勞和貧血。目前,除了乳腺癌外,阿斯利康和第一三共還在探索Dato-DXd用于非小細胞肺癌的效果,但在2024年9月,該ADC同樣未能在該領域顯示顯著的整體生存改善。Suzetrigine是一種在研的選擇性NaV1.8疼痛信號抑制劑,旨在通過特異性阻斷周圍神經中的鈉通道來阻止疼痛信號傳達到大腦。由于其作用機制僅限于外周神經系統,該藥物不具備阿片類藥物的成癮風險。目前,Vertex正在推動這款非阿片類止痛藥用于治療中度至重度急性疼痛,PDUFA日期為2025年1月30日。
2024年藥時代報道了該藥物用于治療坐骨神經痛(LSR)的臨床試驗結果(推薦閱讀:安慰劑療效顯著?Vertex一夜蒸發130億美元)。為了推動此次Suzetrigine的審評,Vertex提供了兩項II期研究和三項III期研究的數據,其中包括NAVIGATE 1和NAVIGATE 2試驗。這些試驗分別評估了該藥物在進行拇外翻手術和腹部整形術患者中的療效。結果顯示,Suzetrigine單藥治療顯著降低了患者的疼痛評分,在腹部整形術后降低了48.4分,而在接受腳趾手術的患者中則降低了29.3分。與安慰劑相比,這兩種治療效果均具有統計學意義。如果獲得批準,suzetrigine將成為二十多年來首個用于急性疼痛的新藥類別,為臨床醫生提供一種新的工具來管理中度至重度急性疼痛,同時也為患者帶來了無需依賴阿片類藥物的治療選項。2024年11月22日,FDA批準了BridgeBio的Attruby,用于治療野生型或變異型轉甲狀腺素介導的淀粉樣變性心肌病(ATTR-CM)成人以降低心血管死亡和心血管相關的住院。Attruby成為全球首款轉甲狀腺素近完全穩定的治療劑。Alnylam緊跟其后,希望旗下Amvuttra拓展ATTR-CM適應癥。Amvuttra是一款皮下給藥的RNAi療法,此前已批準用于治療遺傳性轉甲狀腺素蛋白淀粉樣變多發性神經病。為了支持其ATTR-CM申請,Alnylam引用了III期HELIOS-B研究的數據。該研究表明,Amvuttra對ATTR-CM患者的生存率、心血管事件、功能能力和生活質量產生了“有利影響”。特別是,在2024年美國心臟協會科學會議上展示的數據指出,Amvuttra治療使得所有原因死亡率和復發性心血管事件的綜合結果降低了28%。這一積極成果促使FDA接受了Alnylam的補充新藥申請,預計評審結果將于2025年3月23日公布。如果獲得批準,Amvuttra將區別于現有TTR穩定劑(BridgeBio的Attruby;輝瑞的Vyndaqel、Vyndamax),成為首款用于ATTR-CM的RNA干擾療法。