12 月 13 日,CDE 官網顯示,恒瑞注射用 SHR-A1811(瑞康曲妥珠單抗)擬被納入突破性療法,用于治療 HER2 表達的鉑耐藥復發上皮性卵巢癌、輸卵管癌或原發性腹膜癌。
此前瑞康曲妥珠單抗已經有 6 次納入突破性治療,若是此次通過公示,將成為該藥物的第 7 次突破性療法認定。
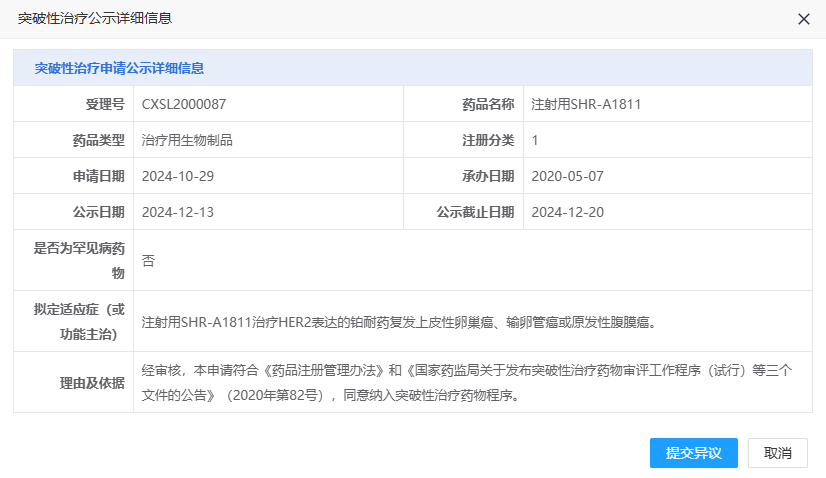
截圖來源:CDE 官網
瑞康曲妥珠單抗是恒瑞醫藥自主研發的 HER2 ADC,由曲妥珠單抗、可裂解連接子及拓撲異構酶 I 抑制劑有效載荷 SHR169265 組合而成,其有效載荷 SHR169265 不僅具有更高的膜穿透能力,還顯著增強了細胞殺傷效果。更關鍵的是,該藥物在連接子與毒素之間創新性地引入了手性環丙基設計,極大地提升了藥物化學穩定性,有效控制了毒素的精準釋放,并顯著降低了早期釋放可能引發的副作用。
值得一提的是,此前瑞康曲妥珠單抗已經有 6 個適應癥獲得突破性療法認定:
用于 HER2 陽性的復發或轉移性乳腺癌患者;
用于 HER2 低表達的復發或轉移性乳腺癌;
單藥治療既往含鉑化療失敗的 HER2 突變的晚期非小細胞肺癌(NSCLC)患者;
單藥治療既往經奧沙利鉑、氟尿嘧啶和伊立替康治療失敗、HER2 陽性結直腸癌;
既往至少一線抗 HER2 治療失敗的 HER2 陽性晚期胃癌或胃食管結合部腺癌患者;
縱觀全球研究情況來看,目前有 3 款 HER2 ADC 新藥已獲批上市,分別是榮昌生物的維迪西妥單抗、第一三共的德曲妥珠單抗和 ImmunoGen 的恩美曲妥珠單抗。僅榮昌生物一款是國產。
其他國產 HER2 ADC 新藥處于上市申請階段的有 2 款,分別來自恒瑞的瑞康曲妥珠單抗和科倫藥業的博度曲妥珠單抗。
除此以外,進入臨床 III 期階段的有 6 款,分別來自百利天恒、正大天晴、石藥集團、康寧杰瑞、映恩生物和樂普生物。
由此可見,恒瑞在國產 HER2 ADC 領域處于第一梯隊。并且瑞康曲妥珠單抗在國產同類藥物中獲得的突破性療法認定最多的,其中多個在研適應癥大都是進度相對靠前,例如:
在 HER2 陽性結直腸癌領域,全球尚無 HER2 ADC 獲批,恒瑞在同類產品中的進度第一,正在國內開展 Ⅲ 期臨床。
在 HER2 陽性晚期胃癌或胃食管結合部腺癌領域,目前有兩款產品獲批(德曲妥珠單抗、維迪西妥單抗),恒瑞進度第三,正在開展 Ⅲ 期臨床。
在 HER2 低表達復發或轉移性乳腺癌領域,國內目前僅有德曲妥珠單抗獲批,恒瑞正在開展 Ⅲ 期臨床;
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..