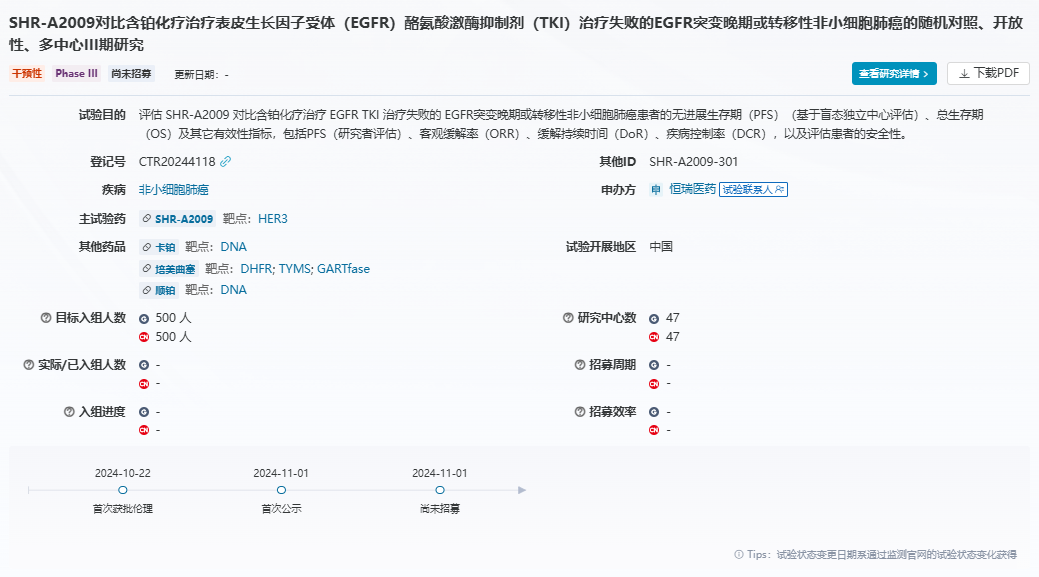
11月1日,藥物臨床試驗登記與信息公示平臺顯示,恒瑞醫藥啟動了HER3 ADC藥物SHR-A2009的首個III期研究。該研究是一項多中心、隨機、開放標簽臨床試驗,擬納入500例接受EGFR-TKI治療失敗的EGFR突變型晚期或轉移性非鱗狀非小細胞肺癌(NSCLC)患者,旨在評估SHR-A2009對比含鉑化療在這類患者中的療效和安全性。研究的主要終點為無進展生存期(PFS)。SHR-A2009是恒瑞醫藥自主研發的一款HER3 ADC藥物,由全人源HER3 IgG1單克隆抗體、可酶切的含馬來酰亞胺四肽(GGFG)的linker和拓撲異構酶I抑制劑9106-IM-2組成,平均藥物抗體偶聯比(DAR)為4。今年9月,恒瑞醫藥在ESMO 2024大會上公布了SHR-A2009治療接受過中位2(1-7)線治療的EGFR突變型NSCLC的I期研究數據。結果顯示,中位隨訪8.6個月時,接受9.0mg/kg SHR-A2009治療的52例患者的客觀緩解率(ORR)為46.9%(23/49),疾病控制率(DCR)達到93.9%,PFS為9.6個月。目前,全球尚無HER3 ADC藥物獲批上市,不過已有一款HER3 ADC在美國提交上市申請,即第一三共與默沙東合作開發的HER3-DXd(patritumab deruxtecan)。SHR-A2009是目前唯一一款開發進度僅次于HER3-DXd的HER3 ADC藥物。此外,百利天恒開發了一款HER3/EGFR雙抗ADC藥物倫康依隆妥單抗,該產品目前處于III期階段。