在過(guò)去的一個(gè)世紀(jì)里,治療藥物已經(jīng)從植物提取物發(fā)展到了化學(xué)定義的小分子,又發(fā)展到了基于大分子的重組蛋白。經(jīng)過(guò)幾十年不懈的科學(xué)努力,前景被設(shè)想了幾十年的基因和細(xì)胞治療,現(xiàn)在已開(kāi)始推動(dòng)治療藥物格局的下一步改變,為此前無(wú)法解決的疾病開(kāi)辟了全新的治療途徑。目前獲批的多種此類(lèi)治療產(chǎn)品包括用于細(xì)胞治療的Maci、Kymriah、Yescarta和Tecartus,以及用于體內(nèi)基因治療的Luxturna和Zolgensma®。這一系列的療法一起促成了數(shù)百項(xiàng)臨床試驗(yàn)的啟動(dòng),這些試驗(yàn)預(yù)示著在未來(lái)十年內(nèi)可能將出現(xiàn)更為成功的治療方法。Luxturna治療視網(wǎng)膜營(yíng)養(yǎng)不良,Zolgensma®治療脊髓性肌肉萎縮,其都是具有突破性的治療方法,患者數(shù)量雖少,但非常重要。隨著基因治療的成熟,更常見(jiàn)的疾病,如實(shí)體瘤,將以更大的患者群體出現(xiàn),作為此類(lèi)產(chǎn)品的治療對(duì)象。
為了更好地利用基因和細(xì)胞治療對(duì)于常見(jiàn)疾病的明確且巨大潛力,其制造過(guò)程需要提高生產(chǎn)力和效率。早期的制造工藝是在科研實(shí)驗(yàn)室中開(kāi)發(fā)的,使用的技術(shù)不是為工業(yè)性規(guī)模放大而設(shè)計(jì)的。在這份專(zhuān)門(mén)針對(duì)基因治療的白皮書(shū)中,我們將這種用于早期基因治療臨床和商業(yè)化批次的前期工作稱(chēng)為基因治療制造1.0 (GTM 1.0)。早期基因治療的過(guò)早成功,加上GTM 1.0的局限性,已經(jīng)造成了一個(gè)巨大的供應(yīng)鏈缺口,病毒載體的需求超過(guò)了當(dāng)前的供應(yīng)量,而且這個(gè)缺口還在擴(kuò)大。行業(yè)迫切需要可提高生產(chǎn)力和效率的重大技術(shù)發(fā)展,以滿足當(dāng)前的需求,并推動(dòng)未來(lái)的工作。本文總結(jié)了一些GTM 1.0面臨的挑戰(zhàn),并將介紹潛在的基因治療制造2.0(GTM 2.0)在生產(chǎn)力、可放大性和安全性方面的改進(jìn)。
制造需求缺口
決定基因治療需求的大量變量,包括適應(yīng)癥、處方劑量和患者數(shù)量,阻礙了明確未來(lái)價(jià)值的計(jì)算。不過(guò),為了更好地理解不同的復(fù)雜情況,一些研究人員已經(jīng)建立了預(yù)測(cè)模型。來(lái)自麻省理工學(xué)院(MIT)的Quinn等人開(kāi)發(fā)了一個(gè)基線模型,用于預(yù)測(cè)針對(duì)不同疾病的獲批療法的數(shù)量和患者群體(1)。根據(jù)條件的差異,每種療法的患者人數(shù)可從100人(如眼科治療)到超過(guò)20,000人(如神經(jīng)治療)不等。該模型的輸出估計(jì)“到2030年,可能會(huì)有35萬(wàn)患者使用30到60種不同的基因療法進(jìn)行治療。”據(jù)估計(jì),到2030年,每年可治療的患者數(shù)量將達(dá)到5萬(wàn)人,很可能至少是目前患者數(shù)量的10倍。在第二個(gè)模型中,Rininger等人(2)通過(guò)編排一系列治療適應(yīng)癥中每個(gè)患者的劑量,估算了AAV和慢病毒載體的生產(chǎn)需求和產(chǎn)能,從而可以推算出AAV和慢病毒生產(chǎn)的年需求量。例如,他們估計(jì)血液病適應(yīng)癥的平均劑量為每位患者5 x 10^8 TU慢病毒。假設(shè)我們考慮每年至少治療15,000名患有這種疾病的患者,那么每年就需要生產(chǎn)7.5 x 10^12 TU的慢病毒。對(duì)于肌萎縮癥,作者估計(jì)平均劑量為每人3.9 × 10^15 VG AAV。在美國(guó),5 - 24歲的男性約有1/5600-7700的發(fā)病率(3),世界范圍內(nèi)約有1萬(wàn)名杜氏肌萎縮癥患者,這將需要大約4 × 10^19 VG AAV。盡管Quinn等人的模型和Rininger等人的模式使用不同的目標(biāo)、策略和假設(shè)構(gòu)建,但得出相同的結(jié)論;病毒載體的供需缺口要么已經(jīng)存在,要么很快就會(huì)出現(xiàn)。
病毒載體供需缺口源于這樣一個(gè)事實(shí):病毒載體制造技術(shù)和工藝主要是由重組蛋白和單克隆抗體(mAb)工藝重新利用而來(lái),而非優(yōu)化。將投放市場(chǎng)的時(shí)間優(yōu)先于技術(shù)和工藝優(yōu)化,加劇了供需之間的差距。耗時(shí)的優(yōu)化迭代過(guò)程在很大程度上被放棄了,因?yàn)橹灰a(chǎn)出所需數(shù)量的病毒載體,低產(chǎn)量工業(yè)通常也會(huì)被認(rèn)為是“足夠好了”。而在之后的商業(yè)化制造中,這就成為了一個(gè)重要的工藝瓶頸。
短缺的影響因指標(biāo)的不同而有很大差異。例如,一種血液腫瘤的總制造需求,估計(jì)為每年需要7.5 x 10^12 TU慢病毒,可能可以通過(guò)現(xiàn)有的GTM 1.0技術(shù)來(lái)滿足。一個(gè)總收率為30%的100 m2固定床貼壁生物反應(yīng)器,一年內(nèi)運(yùn)行20次,很可能滿足這樣的需求。
但考慮到每年會(huì)有1萬(wàn)名肌肉萎縮癥患者時(shí),情況就不一樣了。同樣,使用估計(jì)的數(shù)字,一個(gè)3,000 L的STR每年可進(jìn)行20批,產(chǎn)量為1 × 10^10 AAV vg/day/mL,總工藝收率為30%,即可提供~5 × 10^17 VG AAV。為了滿足4 × 10^19的要求,需要80個(gè)3,000 L生物反應(yīng)器,每個(gè)反應(yīng)器每年運(yùn)行20個(gè)批次,這是不合理的。
病毒載體產(chǎn)量的每一個(gè)數(shù)量級(jí)的增加都將為該領(lǐng)域創(chuàng)造新的機(jī)會(huì)。產(chǎn)量增加10倍將顯著降低成本,擴(kuò)大現(xiàn)有療法的可及性,使患者能夠更公平地獲得治療,并擴(kuò)大全球渠道。100倍的提升將把適應(yīng)癥,如肌肉萎縮和其它疾病,帶入到可實(shí)現(xiàn)的制造方案范疇內(nèi)。最后,1,000倍的提升可以讓基因治療進(jìn)入一個(gè)新時(shí)代,在這個(gè)時(shí)代里,它可以治療患者群體數(shù)量更大的常見(jiàn)疾病,并徹底改變現(xiàn)代醫(yī)療模式。
瞬時(shí)表達(dá)和貼壁細(xì)胞培養(yǎng)受限的生產(chǎn)力和可放大性
目前的上游病毒載體制造過(guò)程主要基于瞬時(shí)表達(dá)技術(shù),雖然其在實(shí)驗(yàn)室環(huán)境中較為方便進(jìn)行,但通常存在產(chǎn)率低且操作復(fù)雜等問(wèn)題,可能會(huì)對(duì)制造的可重復(fù)性造成挑戰(zhàn)。對(duì)于AAV和慢病毒,利用瞬時(shí)表達(dá),分別有報(bào)道獲得了1 - 5 × 10^4 VG/cell(5)和1 - 10 TU/cell (6)的細(xì)胞特異性產(chǎn)率。大多數(shù)系統(tǒng)需要3到4個(gè)DNA質(zhì)粒,每個(gè)都具有特定的復(fù)雜性,需要對(duì)多個(gè)質(zhì)粒進(jìn)行多個(gè)參數(shù)的優(yōu)化,如DNA與轉(zhuǎn)染試劑的比例、DNA與細(xì)胞的比例以及孵育時(shí)間,這會(huì)增加執(zhí)行DOE所需的資源量,也會(huì)增加單元操作執(zhí)行過(guò)程中發(fā)生偏差的風(fēng)險(xiǎn)。此外,轉(zhuǎn)染試劑會(huì)影響細(xì)胞生長(zhǎng),轉(zhuǎn)染后活細(xì)胞密度一般會(huì)下降,這意味著能夠?qū)崿F(xiàn)轉(zhuǎn)染的試劑也會(huì)降低可用于生產(chǎn)的細(xì)胞。這種復(fù)雜性在為臨床應(yīng)用制造高質(zhì)量質(zhì)粒時(shí),將轉(zhuǎn)化為巨大的成本,導(dǎo)致多質(zhì)粒轉(zhuǎn)染成為整體工藝成本的重要因素(4)。
通過(guò)提高對(duì)細(xì)胞代謝和蛋白質(zhì)分泌的理解,重組蛋白和單克隆抗體的細(xì)胞特異性產(chǎn)率已經(jīng)實(shí)現(xiàn)了數(shù)倍的提升。將這種方法擴(kuò)展到基因治療將是針對(duì)供需缺口的有效解決方案,但其不太可能趕上目前臨床管線的快速時(shí)間線,因?yàn)椋壳皢慰寺】贵w細(xì)胞特異性產(chǎn)率10 - 100倍的提升花了大約20年的時(shí)間。鑒于病毒載體在生物化學(xué)上比大多數(shù)重組蛋白和單克隆抗體更為復(fù)雜,要使病毒載體細(xì)胞特異性產(chǎn)率獲得相當(dāng)?shù)奶嵘A(yù)計(jì)至少需要相似的時(shí)間。此外,考慮到代謝和病毒載體分子的細(xì)微差別,針對(duì)某一產(chǎn)品的細(xì)胞特異性產(chǎn)率解決方案不太可能廣泛適用。
貼壁細(xì)胞培養(yǎng)工藝是一種在實(shí)驗(yàn)室規(guī)模條件下獲得基因治療產(chǎn)品的有效的方法,而其在生產(chǎn)規(guī)模條件下,最終將遇到不小的挑戰(zhàn)。雖然貼壁培養(yǎng)很容易生長(zhǎng),且可通過(guò)培養(yǎng)基置換而維持,但其細(xì)胞密度通常較低(~1 × 10^6 cells/mL),且受限于扁平培養(yǎng)容器的尺寸。市面上最大的平面培養(yǎng)設(shè)備(~2.5 m2, ~6 L培養(yǎng)基體積)對(duì)于AAV和慢病毒,分別可提供不高于3 × 10^14VG和6 × 10^10 TU的產(chǎn)量。將設(shè)備面積增加100 X,至250 m2或以上,以滿足需求差距,并不是一種實(shí)用或可執(zhí)行的解決方案。與規(guī)模放大不同的是,使用大量小型容器進(jìn)行規(guī)模擴(kuò)展有其自身的障礙,包括:自動(dòng)化所需的設(shè)備成本高昂、復(fù)雜性增加、生產(chǎn)占地以及勞動(dòng)力需求。作為向前發(fā)展的一步,新一代固定床生物反應(yīng)器已被證明可以將每個(gè)生物反應(yīng)器的病毒載體產(chǎn)量提高100X,如對(duì)于AAV,可達(dá)~2 × 10^16 VG(7),對(duì)于慢病毒,可達(dá)~1 × 10^12 TU(8),但這仍然不足以滿足需求。目前最大的固定床生物反應(yīng)器只到500 m2,放大到相當(dāng)于2,000 – 3,000 L STR的規(guī)模仍然無(wú)法實(shí)現(xiàn)。
非優(yōu)化的下游導(dǎo)致低收率
從生物藥工藝到病毒載體工藝的過(guò)濾和層析方法的轉(zhuǎn)化確實(shí)可實(shí)現(xiàn)所需產(chǎn)品的生產(chǎn),但回收率遠(yuǎn)低于預(yù)期水平。單抗的整體下游收率通常能達(dá)到80%,而病毒載體通常只能達(dá)到30%,有些甚至低至10%。與蛋白質(zhì)相比,病毒載體具有更大的結(jié)構(gòu)和生化復(fù)雜性,可應(yīng)用的方法更少,穩(wěn)定的緩沖液和溫度條件選擇更有限。例如,通常用于蛋白質(zhì)的低pH值和高電導(dǎo)緩沖條件會(huì)導(dǎo)致病毒失活,如脆弱的、有囊膜的慢病毒。大多數(shù)產(chǎn)品損失發(fā)生在非優(yōu)化的層析分離方法,需要在純度和收率之間進(jìn)行折衷。
親和填料能有效地去除AAV中的宿主細(xì)胞蛋白(HCP)和DNA雜質(zhì),但受到AAV血清型多樣性的挑戰(zhàn),并不是所有的衣殼都能與目前市售的AAV填料結(jié)合,而能夠結(jié)合的衣殼的回收率也各不相同,公布的結(jié)果在50% - 90%之間(9、10)。
AAV精制步驟主要作用是將缺乏DNA(空)的衣殼從含有DNA(完整)的衣殼中分離出來(lái)。核酸被包裹在衣殼內(nèi),它的存在可改變整個(gè)病毒的有效等電點(diǎn),在大多數(shù)情況下,至少可以通過(guò)離子交換部分分離兩種物質(zhì)。然而,部分分離要求在產(chǎn)量和純度之間進(jìn)行操作選擇;在完整衣殼純度較低的情況下,可能獲得較高的總收率;反之亦然,更高純度的完整衣殼一般伴隨著較低的總收率。由于純度通常被優(yōu)先考慮,這一關(guān)鍵步驟的收率會(huì)受到影響。使用離子交換層析從完整衣殼中分離空衣殼也增加了開(kāi)發(fā)、驗(yàn)證和規(guī)模放大的時(shí)間,原因在于多方面的變量,包含但不限于,形式(填料、膜和整體柱)、化學(xué)(不同配基密度的強(qiáng)或弱陰離子和陽(yáng)離子基團(tuán))、以及分離條件(pH、電導(dǎo)率、緩沖液組成、梯度或步驟洗脫)。
目前還沒(méi)有開(kāi)發(fā)用于慢病毒的親和配基,使離子交換層析成為了主要的方法,而體積排阻層析(SEC)是次優(yōu)的第二方法。在收獲和初步處理后,通過(guò)基于膜的離子交換吸附劑進(jìn)行澄清,拋棄傳統(tǒng)的UF/DF濃縮和洗濾,為慢病毒純化提供了另一種解決方案。膜層析后較小的洗脫體積允許第二步的柱層析以較慢的流速進(jìn)行。下游工藝中的過(guò)濾步驟,如使用深層過(guò)濾(11,12)進(jìn)行的澄清和使用切向流過(guò)濾(TFF)(13)進(jìn)行的產(chǎn)物濃縮和制劑,也經(jīng)常會(huì)導(dǎo)致產(chǎn)物損失。吸附至過(guò)濾介質(zhì)、剪切應(yīng)力和滯留體積都是工藝過(guò)程中產(chǎn)物損失或失活的原因。
工藝安全性
GTM 1.0技術(shù)缺乏污染物去除和確保工藝安全性的適當(dāng)工具。由于產(chǎn)品本身是病毒或病毒載體,治療性蛋白質(zhì)污染物(細(xì)菌或外來(lái)病毒)去除技術(shù),如低pH值病毒滅活和除菌/除病毒過(guò)濾,并不總是兼容的。這就迫切需要防止污染而不是去除污染。
此外,用于在線監(jiān)測(cè)產(chǎn)品關(guān)鍵質(zhì)量屬性(CQA)的分析技術(shù)在基因治療中也有限。一般來(lái)說(shuō),隨著分子復(fù)雜性的增加,分析方法也將變得更加復(fù)雜。從小分子到重組蛋白,質(zhì)譜等方法用了幾十年的時(shí)間才適應(yīng)新的要求。基因和細(xì)胞治療需要對(duì)現(xiàn)有方法和新的分析技術(shù)進(jìn)行類(lèi)似的調(diào)整。由于pH值、電導(dǎo)率和壓力條件不能直接檢測(cè)基因和細(xì)胞治療產(chǎn)品的質(zhì)量,因此將需要新的方法在線監(jiān)測(cè)關(guān)鍵質(zhì)量屬性(CQA)。大多數(shù)基因治療分析方法都是離線進(jìn)行的,其中一些方法,如通過(guò)透射電子顯微鏡(TEM)定量檢測(cè)AAV衣殼,可能需要長(zhǎng)達(dá)兩周的時(shí)間。
向基因治療制造2.0躍進(jìn)
生產(chǎn)細(xì)胞系強(qiáng)化懸浮細(xì)胞培養(yǎng)的優(yōu)勢(shì)
多家基因治療公司已經(jīng)明確有必要升級(jí)GTM 1.0,以填補(bǔ)供需缺口,這些公司正在迅速采用和實(shí)施創(chuàng)新技術(shù),以快速過(guò)渡到GTM 2.0,并已取得一些重大成果。
GTM 2.0的大部分工作集中在提高細(xì)胞培養(yǎng)效率,使用的方法與開(kāi)發(fā)用于治療性蛋白質(zhì)的方法相似。許多過(guò)往的改進(jìn),如培養(yǎng)基優(yōu)化和補(bǔ)液策略,已獲得了顯著的增量收益,但不是革命性的改變。基因治療需要實(shí)現(xiàn)的最關(guān)鍵的細(xì)胞培養(yǎng)步驟變化,同樣也發(fā)生在重組蛋白的生產(chǎn)中,即將貼壁細(xì)胞轉(zhuǎn)變?yōu)閼腋∧J健km然貼壁細(xì)胞提供了快速獲取適量物料的簡(jiǎn)易收獲方法,并可降低雜質(zhì),但規(guī)模放大的挑戰(zhàn)妨礙了其在臨床或商業(yè)化生產(chǎn)階段的廣泛適用性。Repligen的數(shù)據(jù)顯示,60%的基因治療公司已經(jīng)從貼壁平臺(tái)過(guò)渡到了懸浮模式,30%的公司同時(shí)支持兩個(gè)平臺(tái),10%的公司仍然堅(jiān)持貼壁模式。對(duì)懸浮細(xì)胞的投資可以為促進(jìn)工藝規(guī)模放大、擴(kuò)大細(xì)胞培養(yǎng)體積以及提高病毒滴度提供顯著的好處。懸浮細(xì)胞也增加了一個(gè)安全的因素,因?yàn)樗鼈兺ǔIL(zhǎng)在無(wú)血清的化學(xué)限定培養(yǎng)基中。然而,在懸浮模式中,觀察到的病毒滴度通常較低,因此需要使用其它方案來(lái)進(jìn)一步優(yōu)化工藝。
細(xì)胞截留裝置,如XCell ATF®技術(shù),可以提高生物反應(yīng)器活細(xì)胞密度(VCD)至300 × 10^6 cells/ml以上,而這可通過(guò)幾種不同的方式,用于提高工廠的整體產(chǎn)能。當(dāng)連接到生產(chǎn)生物反應(yīng)器時(shí),細(xì)胞截留裝置可以應(yīng)用于以離散或連續(xù)模式提高產(chǎn)量。在離散模式下,細(xì)胞截留裝置能夠在確定的時(shí)間點(diǎn)從單個(gè)生物反應(yīng)器中進(jìn)行多次收獲,通常稱(chēng)為“補(bǔ)料分批強(qiáng)化”。在連續(xù)灌流模式下,產(chǎn)物在整個(gè)生產(chǎn)過(guò)程中從生物反應(yīng)器中獲得,通常稱(chēng)為“灌流”。在任何一種模式中,生產(chǎn)生物反應(yīng)器的產(chǎn)量將增加,且停機(jī)時(shí)間降低。
細(xì)胞截留裝置通過(guò)同時(shí)執(zhí)行收獲和澄清步驟,可進(jìn)一步強(qiáng)化上游操作。每個(gè)細(xì)胞截留裝置包含一個(gè)孔徑0.2 - 0.65 μm的過(guò)濾器,條件培養(yǎng)基通過(guò)過(guò)濾器進(jìn)入濾液。因此,收獲的物料可以直接從收獲進(jìn)入層析操作,而不需要離心或深層過(guò)濾,形成了額外的工藝效率。
細(xì)胞截留裝置也可用于提高種子擴(kuò)增生物反應(yīng)器的細(xì)胞密度。美國(guó)Cytovance® Biologics最近的一項(xiàng)研究表明,通過(guò)提高VCD,在病毒載體生產(chǎn)工藝中,產(chǎn)量提高了一個(gè)數(shù)量級(jí)。標(biāo)準(zhǔn)細(xì)胞培養(yǎng)的VCD可達(dá)到~1.3 × 10^6 cells/ml,而強(qiáng)化工藝的VCD提高了10倍,達(dá)到~1.2 × 10^7 cells/ml。VCD的提高意味著收獲的衣殼量的提高。標(biāo)準(zhǔn)進(jìn)料分批工藝可產(chǎn)生1-3 × 10^10 capsids/ml,而XCell ATF®強(qiáng)化工藝的產(chǎn)量提高了大約100倍,達(dá)到4-10 × 10^12 capsids/ml。
圖1.使用XCell ATF®進(jìn)行的AAV2生產(chǎn)工藝的強(qiáng)化(數(shù)據(jù)來(lái)自(14),由Cytovance® Biologics提供)。使用XCell ATF®細(xì)胞強(qiáng)化裝置進(jìn)行的灌流工藝(轉(zhuǎn)染前)的AAV2產(chǎn)量相比標(biāo)準(zhǔn)批次工藝提高了>100倍的衣殼生產(chǎn)。
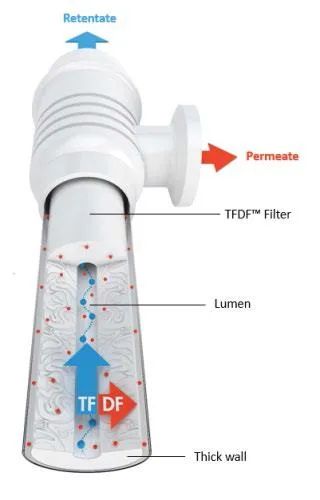
圖2.切向流深層過(guò)濾(TFDF®)以切向模式運(yùn)行深層過(guò)濾器。細(xì)胞培養(yǎng)基通過(guò)管狀深層過(guò)濾器的管腔。濾液通過(guò)深層過(guò)濾器管壁,并從濾液端口流出。回流液離開(kāi)管腔并直接返回至生物反應(yīng)器。
使用新型TFDF®技術(shù)也可以實(shí)現(xiàn)細(xì)胞截留,該技術(shù)已經(jīng)證明了其在提高慢病毒產(chǎn)率方面的卓越性能。TFDF®技術(shù)將切向流和深層過(guò)濾結(jié)合在一次性使用且封閉的過(guò)濾裝置內(nèi)。具有2-5 μm孔徑的厚壁管狀深層過(guò)濾器能夠捕獲細(xì)胞和細(xì)胞碎片,產(chǎn)物截留可忽略不計(jì)。切向流通過(guò)引導(dǎo)大部分細(xì)胞和細(xì)胞碎片朝向回流端流動(dòng)并遠(yuǎn)離過(guò)濾器,從而降低污染(圖2)。切向流和深層過(guò)濾的空前結(jié)合,可獲得高度澄清的溶液,且可穩(wěn)健對(duì)抗污染。Oxford Biomedica最近發(fā)表的一篇文章報(bào)道,與標(biāo)準(zhǔn)批次收獲相比,使用TFDF®,慢病毒產(chǎn)量提高了兩倍以上(15)。對(duì)于標(biāo)準(zhǔn)補(bǔ)料分批生物反應(yīng)器的單次收獲,深層過(guò)濾收率為~70%,而TFDF®的收率為~90%。更重要的是,由于TFDF®在低剪應(yīng)力的切向模式下操作,而不是作為一個(gè)死端過(guò)濾器,完整的細(xì)胞被截留在生物反應(yīng)器中。用新鮮培養(yǎng)基補(bǔ)充生物反應(yīng)器,可使細(xì)胞能夠繼續(xù)產(chǎn)生病毒,并在幾天后進(jìn)行第二次收獲。與基于深層過(guò)濾的單次收獲工藝相比,每次收獲更高的收率與二次收獲的綜合效益,使TFDF®工藝的產(chǎn)量達(dá)到了原始工藝的~250%。TFDF®技術(shù)還可以降低病毒失活的風(fēng)險(xiǎn),其通過(guò)一系列的快速收獲,從生物反應(yīng)器中取出產(chǎn)物,而不是在高細(xì)胞密度、高溫度的生物反應(yīng)器中積累慢病毒。
到目前為止,細(xì)胞培養(yǎng)強(qiáng)化主要應(yīng)用于瞬時(shí)系統(tǒng)中轉(zhuǎn)染前的細(xì)胞擴(kuò)增。穩(wěn)定細(xì)胞系的開(kāi)發(fā),將消除質(zhì)粒轉(zhuǎn)染的需求,有助于實(shí)現(xiàn)細(xì)胞培養(yǎng)強(qiáng)化的全部?jī)?yōu)勢(shì)。已經(jīng)有文章報(bào)道過(guò)慢病毒(6、16)和AAV(9)穩(wěn)定細(xì)胞系的早期案例。含病毒衣殼基因的包裝細(xì)胞系也被認(rèn)為是減少對(duì)轉(zhuǎn)染步驟依賴(lài)性的一種可行方法,雖然其仍需要轉(zhuǎn)染攜帶目的基因的質(zhì)粒,但與目前的多質(zhì)粒轉(zhuǎn)染工藝相比,單質(zhì)粒轉(zhuǎn)染將大大簡(jiǎn)化工藝,降低整體生產(chǎn)時(shí)間。從轉(zhuǎn)染貼壁細(xì)胞瞬時(shí)表達(dá)到穩(wěn)定表達(dá)懸浮平臺(tái)的過(guò)渡可實(shí)現(xiàn)GTM 2.0定義所需的10至100倍的上游產(chǎn)量提升。
上游病毒載體產(chǎn)量的數(shù)量級(jí)提升將需要下游工藝中相應(yīng)的步驟變化改進(jìn)。澄清,一個(gè)經(jīng)常被忽視的工藝強(qiáng)化機(jī)會(huì),現(xiàn)在可以通過(guò)多種技術(shù)來(lái)提高產(chǎn)量,減少資源需求,或直接將收獲與澄清相結(jié)合。TFDF®是最新開(kāi)發(fā)的過(guò)濾模式之一,其可用于澄清步驟(以及生物反應(yīng)器強(qiáng)化)。通過(guò)引導(dǎo)絕大部分細(xì)胞通過(guò)循環(huán)回路返回至生物反應(yīng)器,而不是進(jìn)入死端深層過(guò)濾器,TFDF®極大地提高了過(guò)濾能力和通量(圖3)。增加的過(guò)濾能力允許TFDF®技術(shù)使用較低的過(guò)濾表面積澄清高密度細(xì)胞培養(yǎng)液,隨著細(xì)胞密度的不斷增加,這一點(diǎn)非常重要。簡(jiǎn)單地放大傳統(tǒng)深層過(guò)濾器的表面積,以適應(yīng)更高的生物反應(yīng)器細(xì)胞密度,將顯著提高澄清資源要求,包括操作時(shí)間、成本、緩沖液、WFI、車(chē)間空間以及GMP存儲(chǔ)空間。將過(guò)濾器的尺寸縮小10倍,可以在不同的具體情況下,緩解上述每一個(gè)考慮因素,不僅可以在某一工藝的強(qiáng)化中扮演重要的角色,還可以強(qiáng)化整個(gè)工廠,以使每天、每平方英尺工廠空間可提供更多的產(chǎn)品。此外,TFDF®過(guò)濾器采用伽馬輻照的整合式干型流路形式發(fā)貨,不需要使用WFI或緩沖液沖洗。

圖3. KrosFlo® TFDF®系統(tǒng)使用循環(huán)回路,使細(xì)胞培養(yǎng)液和細(xì)胞從生物反應(yīng)器流出,通過(guò)TFDF®過(guò)濾器的管腔,再返回到生物反應(yīng)器。進(jìn)入管狀深層過(guò)濾器壁的細(xì)胞數(shù)量降低,從而顯著提高了過(guò)濾能力。
用于快速下游工藝開(kāi)發(fā)的高通量工具
針對(duì)基因治療產(chǎn)品的下游技術(shù)的開(kāi)發(fā)將是非常有益的,但由于它們不太可能在未來(lái)兩到三年內(nèi)實(shí)現(xiàn),因此需要快速優(yōu)化現(xiàn)有的方法來(lái)實(shí)現(xiàn)這種新應(yīng)用。高通量工具提供了一種可用且易于實(shí)施的方法,以彌補(bǔ)由于對(duì)進(jìn)入市場(chǎng)的速度進(jìn)行優(yōu)先級(jí)排序而導(dǎo)致分配給下游工藝優(yōu)化的時(shí)間不足的問(wèn)題。微型預(yù)裝層析柱,OPUS® RoboColumn®層析柱是應(yīng)用最廣泛的一種方式,其可以使用96孔板形式和機(jī)器人液體處理工作站實(shí)現(xiàn)自動(dòng)化層析工藝的開(kāi)發(fā)。大量不同的填料、化學(xué)材質(zhì)和純化工藝參數(shù)可以在幾個(gè)小時(shí)內(nèi)完成篩選,且每個(gè)實(shí)驗(yàn)僅需要微升級(jí)樣品體積。預(yù)裝層析柱在工藝放大過(guò)程中繼續(xù)扮演著關(guān)鍵角色。具有高批次可再現(xiàn)性的高質(zhì)量層析柱可節(jié)省操作人員的準(zhǔn)備時(shí)間,但更重要的是,便于驗(yàn)證,提高日程安排的靈活性,加速技術(shù)轉(zhuǎn)移,最終為整個(gè)項(xiàng)目節(jié)省大量時(shí)間和資本支出。
用于產(chǎn)物濃縮和制劑的TFF的優(yōu)化從選擇中空纖維還是平板膜包過(guò)濾器形式開(kāi)始。產(chǎn)物對(duì)剪切的敏感性是影響這一決策的關(guān)鍵參數(shù)。中空纖維由于其開(kāi)放式結(jié)構(gòu),產(chǎn)生的剪切更低。中空纖維形式通常是囊膜病毒工藝的首選,如慢病毒,因其很容易因剪切過(guò)高而失活。對(duì)于更為穩(wěn)定的病毒,如AAV,膜包形式同樣有效,且可能可縮短工藝時(shí)間,甚至可以在有限的過(guò)濾表面積條件下提高濾液通量。確定膜或纖維的截留分子量(MWCO)決定了篩分效果,繼而決定了收率以及雜質(zhì)去除水平。MWCO 500 ~ 750 kDa 的膜可有效地處理慢病毒(~120 nm)等大尺寸的病毒載體。而較小的病毒,如AAV (~25 nm)與MWCO在100 ~ 300 kDa之間的膜配合最好。然后,工藝參數(shù)(跨膜壓或TMP、錯(cuò)流流速、通量)的優(yōu)化可以最大限度地降低工藝時(shí)間和所需的膜表面積。與適當(dāng)規(guī)模的自動(dòng)化系統(tǒng)硬件選擇相結(jié)合,可通過(guò)減少人為錯(cuò)誤,而使收率最大化,降低時(shí)間需求和工藝偏差。
用于提高工藝安全性的封閉式、一次性使用流路
維持單元操作盡可能封閉有助于降低污染的風(fēng)險(xiǎn)。伽瑪輻照、一次性使用、預(yù)組裝的工藝流路提供了一種低生物負(fù)荷、方便且可立即實(shí)施的污染緩解解決方案。供應(yīng)鏈生產(chǎn)多樣化配置的能力正在擴(kuò)大。例如,ProConnex® 流路可以從超過(guò)250個(gè)部件的部件庫(kù)選擇部件進(jìn)行構(gòu)建,包括管路、儲(chǔ)袋和/或容器、過(guò)濾器、傳感器、泵頭和無(wú)菌接頭。流路設(shè)計(jì)的靈活性使封閉式系統(tǒng)的優(yōu)點(diǎn)能夠應(yīng)對(duì)于整個(gè)工作流中廣泛的工藝變化。
用于優(yōu)化工藝監(jiān)測(cè)的更好的分析技術(shù)
用于在線工藝監(jiān)測(cè)的過(guò)程分析技術(shù)可幫助實(shí)現(xiàn)工藝的安全性、操作的方便性,也使工藝更加穩(wěn)健。由于化學(xué)組成的性質(zhì),病毒載體具有不同于單抗和蛋白質(zhì)的CQA,因此需要不同的CQA監(jiān)測(cè)分析技術(shù)。治療性蛋白工藝中常用的工藝參數(shù),如壓力、pH值、電導(dǎo)率和UV也可用于病毒載體工藝,但它們不是產(chǎn)品穩(wěn)定性或純度的有效指標(biāo)。
例如,UF/DF單元操作過(guò)程中的蛋白質(zhì)濃度通常是通過(guò)從流路中提取樣品,然后使用比色皿進(jìn)行耗時(shí)且容易出錯(cuò)的UV-Vis分光光度計(jì)檢測(cè)來(lái)確定的。這種方法在濃縮單元操作結(jié)束時(shí)會(huì)產(chǎn)生不小的挑戰(zhàn),因?yàn)轶w積的小變化可能會(huì)導(dǎo)致產(chǎn)物濃度的大變化。取樣、稀釋樣品和檢測(cè)濃度的繁瑣、步進(jìn)式過(guò)程迫使操作者必須在工藝控制和工藝時(shí)間之間進(jìn)行權(quán)衡。如果工藝控制為優(yōu)先級(jí),那么將停止?jié)饪s,直到獲得可用的分析數(shù)據(jù),這會(huì)導(dǎo)致整個(gè)完成時(shí)間的延長(zhǎng)。或者,如果工藝時(shí)間為優(yōu)先級(jí),那么在分析過(guò)程中將允許濃縮繼續(xù),這會(huì)在實(shí)驗(yàn)流路中的實(shí)際產(chǎn)物濃度與UV-Vis分光光度計(jì)中分析的產(chǎn)物濃度之間產(chǎn)生一個(gè)滯后,導(dǎo)致過(guò)度濃縮。
Slope Spectroscopy®(斜率光譜法)技術(shù)的開(kāi)發(fā)大大簡(jiǎn)化了UV-Vis光譜法檢測(cè),其消除了樣品制備過(guò)程中對(duì)連續(xù)稀釋的需求。Beer-Lambert公式(A=e*C*l)將吸光度(a)描述為消光系數(shù)(e)、濃度(c)和光程(l)的乘積。Slope Spectroscopy®技術(shù)改變光程而保持樣品濃度固定,而傳統(tǒng)的UV-Vis方法維持光程固定,而改變樣品濃度(通過(guò)連續(xù)稀釋?zhuān):?jiǎn)化分析方法的這一部分將在方法和程序級(jí)別上形成多個(gè)級(jí)聯(lián)優(yōu)勢(shì)。UV-Vis標(biāo)準(zhǔn)操作程序(SOP)文件長(zhǎng)度顯著減少,獲得結(jié)果的時(shí)間可從1-2小時(shí)縮短至5-10分鐘。更快的結(jié)果獲得時(shí)間幾乎可允許立即訪問(wèn)分析數(shù)據(jù),以做出關(guān)鍵決策,使?jié)饪s單元操作在更穩(wěn)健的監(jiān)測(cè)條件下,快速完成。對(duì)于需在多個(gè)組和/或地點(diǎn)之間轉(zhuǎn)移的工藝,這一精簡(jiǎn)且穩(wěn)健的單步驟操作可通過(guò)消除可能存在差異的操作人員移液和連續(xù)稀釋步驟,而節(jié)省數(shù)月的技術(shù)轉(zhuǎn)移時(shí)間。
最近,Slope Spectroscopy®技術(shù)在向GTM2.0發(fā)展的道路上又邁出了重要一步,其經(jīng)工程設(shè)計(jì),而可作為在線儀器,與UF/DF流路相整合(圖4)。在線監(jiān)測(cè)可以實(shí)現(xiàn)無(wú)與倫比的工藝控制,這是影響病毒載體等治療藥物穩(wěn)定性的一個(gè)重要因素。使用FlowVPE® Slope Spectrometer®在AAV濃縮和洗濾單元操作中獲得的初步數(shù)據(jù)表明,在線獲得的UV-Vis數(shù)據(jù)與離線獲得的數(shù)字液滴QPCR(ddQPCR)之間存在良好的相關(guān)性(圖5)。
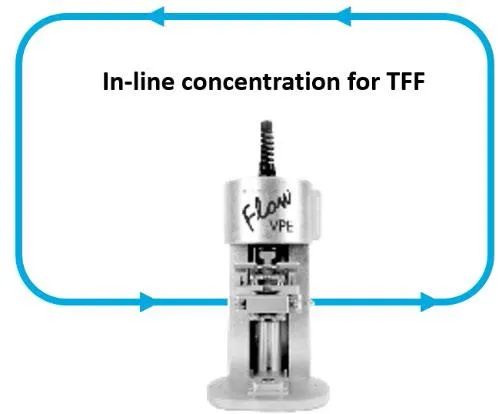
圖4. Flow VPE®設(shè)備整合至TFF流路,用于在線監(jiān)測(cè)產(chǎn)物濃度。
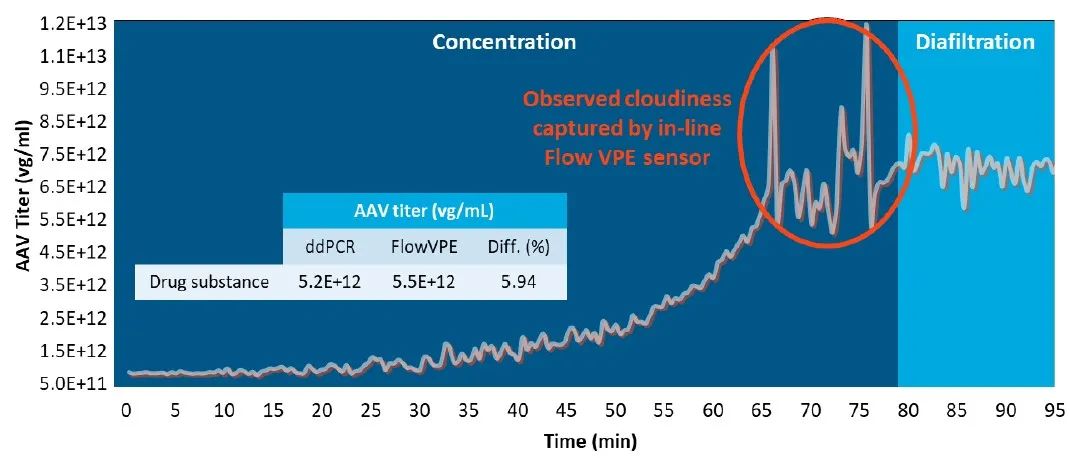
圖5. 使用Slope Spectroscopy® FlowVPE®技術(shù),在最終濃縮和洗濾工藝步驟中,進(jìn)行AAV滴度的在線監(jiān)測(cè)。在線監(jiān)測(cè)可以在發(fā)生工藝偏差時(shí)進(jìn)行快速調(diào)整(例如,觀察到渾濁現(xiàn)象,其表明可能存在病毒聚集,需要停止?jié)饪s和/或改變緩沖液)。
從0到65分鐘,對(duì)濃縮步驟進(jìn)行監(jiān)測(cè),滴度從1.0 x 10^12 vg/ml穩(wěn)定增加到大約6.0 x 10^12 vg/ml。平滑的增長(zhǎng)曲線在65分鐘時(shí)出現(xiàn)偏離,形成了一個(gè)信號(hào)尖峰,突出了在線監(jiān)測(cè)的價(jià)值,其與表明出現(xiàn)病毒聚集的樣品渾濁一致。結(jié)合此觀察結(jié)果,在80分鐘時(shí)開(kāi)始洗濾。在早期開(kāi)發(fā)中,針對(duì)SOP,準(zhǔn)確確定臨界聚集或沉淀濃度可以節(jié)省大量的時(shí)間和物料。在生產(chǎn)環(huán)境中,實(shí)時(shí)數(shù)據(jù)的獲取可以提高產(chǎn)品質(zhì)量,降低工藝偏差,并加快整個(gè)工藝時(shí)間。
總結(jié)
使第一批具有里程碑意義的基因療法成功完成臨床試驗(yàn)和監(jiān)管審批的生產(chǎn)工藝缺乏滿足當(dāng)前需求所需的效率和產(chǎn)量,更不用說(shuō)未來(lái)的需求了。這些工藝,這里稱(chēng)為基因治療制造1.0 (GTM 1.0),受限于瞬時(shí)表達(dá)、貼壁細(xì)胞培養(yǎng)、低純化收率以及離線檢測(cè)CQA的生產(chǎn)力和可放大性挑戰(zhàn)。現(xiàn)有方法的工藝優(yōu)化和新技術(shù)的創(chuàng)新將引領(lǐng)我們走向基因治療制造2.0,整體生產(chǎn)力將提高10到100倍。穩(wěn)定細(xì)胞系產(chǎn)生細(xì)胞,灌流強(qiáng)化的懸浮細(xì)胞培養(yǎng)、產(chǎn)物特異性親和填料、完全封閉的下游操作以及新的分析技術(shù)將很可能被納入其中。未來(lái)五年內(nèi),基因治療制造2.0的出現(xiàn)將有助于確保基因治療供應(yīng)鏈的穩(wěn)定性,并幫助解決目前尚未解決的、危及生命的疾病。
參考文獻(xiàn):
Quinn C. et al., Estimating the clinical pipelineof cell and gene therapies and their potential economic impact on the US healthcare system, Value Health, 2019; 22(6):621–626.
Rininger J. et al., Capacity analysis for viral vector manufacturing: Is there enough?, BioProcess Int., Nov-Dec 2019,17(11–12)s.
Centers for Disease Control and Prevention.(2009). Prevalence of Duchenne/Becker muscular dystrophy among males aged 5-24years—four states, 2007. MMWR Morbidity and Mortality Weekly Report, 58,1119 - 1122. Retrieved June 21, 2012, fromhttp://www.cdc.gov/mmwr/preview/mmwrhtml/mm5840a1.htm.
Cameau E., Pedregal A. and Glover C., Cost modelling comparison of adherent multi-trays with suspension and fixed-bed bioreactors for the manufacturing of gene therapy products, Cell & Gene Therapy Insights 2019; 5(11), 1663–1675.
Grieger J., Soltys S. and Samulski R., Productionof recombinant adeno-associated virus vectors using suspension HEK293 cells and continuous harvest of vector from the culture media for GMP FIX and FLT1clinical vector, Molecular Therapy 2016, 24(2), 287–297.
Manceur A. et al., Scalable Lentiviral Vector Production Using Stable HEK293SF, Human Gene Therapy Methods 2017, 28(6),330-339.
Lefebvre P. et al., Development of a Scalable Viral Vector Upstream Process for Gene Therapy: rAAV-8 Production by Transient Transfection of HEK-293 Cells in iCELLis® Bioreactor, Poster Presented at ESACT2017.
Valkama AJ et al., Optimization of lentiviral vector production for scale-up in fixed-bed bioreactor, Gene Therapy 2018, 25,39–46.
Nass S. et al., Universal method for the purification of recombinant AAV vectors of differing serotypes, Mol Ther Methods Clin Dev. 2017 Dec 22;9:33-46.
Toueille M. et al., Development of purification steps for several AAV serotypes using POROS™ CaptureSelect™ AAVX, Gene Therapy Insights 2018; 4(7), 637-645.
Moss D., Vector purification: issues and challenges with currently available technologies, Cell Gene Ther. Ins. 2019; 5(9):1125–32.
Raghavan B. et al., Optimizing the clarification ofindustrial scale viral vector culture for gene therapy. Cell Gene Ther. Ins.2019; 5(9): 1311–22.
Ruscic J. et al., Lentiviral vector purification using nanofiber ion-exchange chromatography, Molecular Therapy: Methods & Clinical Development 2019, 15, 52-62.
Short C., High Cell Density Perfusion for the Production ofAAV2 Viral Vector Using the Repligen XCell ATF System, Repligen Technical Seminar, Burlingame, CA, Oct 17th,2019.
Williams T. et al., Lentiviral vector manufacturing process enhancement utilizing TFDF™ technology, Cell & Gene Therapy Insights 2020; 6(3), 455–467.
Carrondo M. et al., LentiPro stable producer cells:Delivering scalable and reliable lentiviral vector manufacturing, in "Advancing Manufacture of Cell and Gene Therapies VI", Dolores Baksh, GE Healthcare, USA Rod Rietze, Novartis, USA Ivan Wall, Aston University, United Kingdom Eds, ECI Symposium Series, (2019).
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)組織召開(kāi)
2025版《中國(guó)藥典》將于2025年10月..關(guān)于舉辦四川省藥品生產(chǎn)企業(yè)擬新任質(zhì)量
各相關(guān)企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)召開(kāi)第七
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)第七..“兩新聯(lián)萬(wàn)家,黨建助振興”甘孜行活動(dòng)
為深入貫徹落實(shí)省委兩新工委、省市..學(xué)習(xí)傳達(dá)中央八項(xiàng)規(guī)定精神專(zhuān)題會(huì)議
2025年4月22日,協(xié)會(huì)黨支部組織召..關(guān)于收取2025年度會(huì)費(fèi)的通知
各會(huì)員單位: 在過(guò)去的一年里,..四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)..四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)..