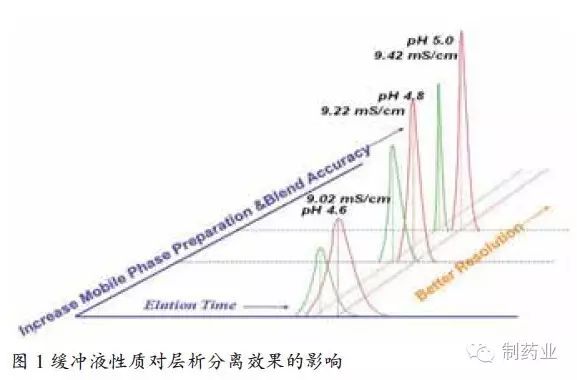
隨著制藥技術的發展和來自監管部門的壓力,未來的藥物開發和新藥申報都將遵循質量源于設計(QbD)的理念。PAT經過FDA推介,已在具備代表性的過程行業——制藥工業中展現重要作用。本文中提到的PAT液體在線稀釋配制系統的應用將助力QbD理念的具體實施。
QbD理念的產生與發展
QbD的本質是闡述產品質量是在設計時賦予的,而不是通過生產或檢驗注入到產品中的,是應用于生物醫藥研發、生產的一種理念,也是一種系統的、基于科學分析的方法。 我國2010版GMP也引入了“質量源于設計”的理念,強調了藥品生產與藥品注冊、上市制度的有效銜接,藥品一經獲得批準,進入生產環節,就必須將與藥品注冊相關的安全性、有效性和質量可控的所有要求,系統地貫徹到藥品生產、控制及產品放行、貯存、發運的全過程,確保所生產的藥品符合預定用途和注冊要求。實施QbD理念,將有助于全面提高我國藥品生產水平和質量,并有助于企業獲得國際商機。 在線過程分析技術(PAT)助力QbD的具體實施 據FDA定義,PAT首先是一個系統,是依據生產過程中的周期性檢測、關鍵質量參數的控制,原材料和中間產品的質量控制及生產全過程控制,確保終產品質量達到認可標準的程序。因其在促進和加強QbD理念在醫藥生產和研發領域的實施而得到FDA的大力推崇。 生物制藥需要很多復雜的緩沖液,而緩沖液的準確和重復對產品質量影響很大。以下將著重討論以PAT技術為基礎的在線液體稀釋配制系統在生物藥下游純化配液過程中的應用。
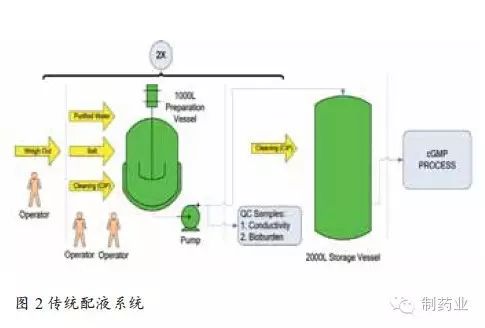

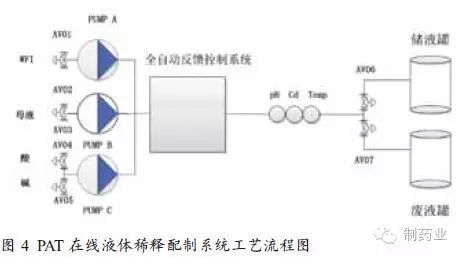
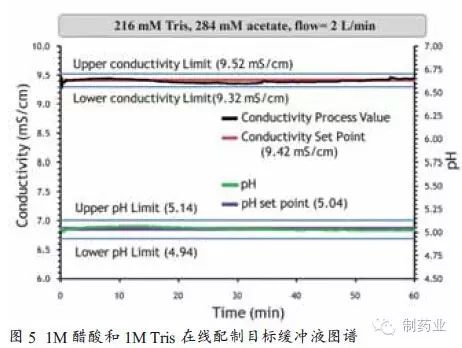
傳統配液系統多依賴人工手動完成,如圖2中所示,配液罐規模為1000L,必須連續配制兩次才可實現2000L目標緩沖液的配制。該配液過程耗費人力物力多,且難以避免人為因素導致的差錯,比如藥品稱量不準或稀釋用注射用水加量偏差。并且目標緩沖液須通過質控的各項檢測指標后方可用于生產,配液周期長。配液罐如用于其它液體的配制,還須進行徹底的清潔和驗證。另一個不容忽視的問題是這些大的配液和儲液罐將占用較多資金和廠方空間。 傳統配液方式存在的諸多問題和不便促使配液相關設備質量和性能的提升逐漸成為生物藥領域關注的焦點,以PAT技術為基礎的液體在線稀釋配制系統的開發解決了以上潛在的監管和金融問題。圖3所示為榮捷生物工程(蘇州)有限公司研發生產的符合GMP要求的液體在線稀釋配制系統。 如圖4所示,PAT在線液體稀釋配制系統共需3臺泵,分別與注射用水、母液和pH調節用酸堿相連,通過pH、電導、溫度等在線監測儀表實現對目標緩沖液的檢測,并通過自動反饋控制系統調節各液體的流速及加量。 該配液系統已進行了相關緩沖液配制實驗。其中泵A與注射用水(WFI)相連,泵B與1M醋酸溶液連接,泵C與1M Tris溶液相連。目標是配制含216mM的Tris(1X)和284mM的醋酸緩沖液,已知目標緩沖液的電導率和pH值分別為9.42mS/cm和5.04,將所需的電導率和pH值作為系統的目標設定值,同時確定可接受的緩沖液標準,本實驗規定目標緩沖液可接受波動范圍為電導率值± 0.1mS/cm和± 0.1個pH單位。 當3種液體(注射用水、醋酸、Tris堿)按比例泵入混合室時,濃縮母液被稀釋至原倍目標緩沖液。此時,通過在線過程分析儀表(pH、電導和溫度探頭)對過程溶液進行監測,并把測量數據傳輸給過程反饋控制回路,控制系統將測量數據與目標值進行比對和計算來調節各泵輸出情況。通過數據的持續監控與反饋調節,使過程緩沖液逐漸趨于目標設定值。當測量值不在可接受范圍內時,液體通過廢液閥和管路排出系統,直至各檢測指標符合要求。只有合格的緩沖液才能進入儲液罐或層析柱進行生物藥分離,從而確保層析分離工藝的穩定性和可重復性。 使用榮捷PAT在線液體稀釋配制系統的配液結果如圖5所示。電導率目標值和過程實時監測值分別用紅線和黑線表示。pH設定值和過程實時監測值分別用紫色和綠色線表示。可以看出,在系統60min的運行過程中,目標緩沖液的電導率和pH值均在QbD設計空間范圍內。該實驗表明PAT液體在線稀釋配液系統可實現配液過程的持續監測和偏差糾正,以保證緩沖液各檢測指標的合格與穩定。精確的和可重復的液體配制,是層析分離效果與QbD預先設計相符的前提條件之一。另外,使用該系統還可節省人員投入,規避人為因素導致的誤差(如母液配制或藥品稱量)。不僅如此,還可減少配液罐和儲液罐的使用,既節省廠房空間又大大減輕罐體清潔驗證帶來的煩惱。總之,PAT在線配液系統的應用將在一定程度上提升QbD理念在生物藥領域的實施效果。目前,已有一些藥企開始將QbD理念和PAT用于藥物研發和生產,并有多篇論文發表用于闡述該理念的實施與效果。[3,4,5] 小結 參考文獻: Single-use Systems Eliminate time-Consuming, Non-revenue generating activities. BioProcess Int. 7(6)2009: S4-S8 [2] ICH: Pharmaceutical Development, 2006, May. Fed. Reg. 71(98)2006; www.ich.org/lob/media/MEDIA4986.pdf [3] Rathore AS, et al. Quality By Design: Industrial Case Studies on Defining and Implementing Design Space for Pharmaceutical Processes — Part 1. BioPharm Int. December 2008 [4] Rathore AS, et al. Quality By Design: Industrial Case Studies on Defining and Implementing Design Space for Pharmaceutical Processes — Part 2. BioPharm Int. December 2008 [5] Li, M.,Kamat, V., Yabe, H., Jariwala, S., Miyabayashi, T. PAT-based In-line Buffer Dilution in Downstream Bioprocessing,, Pharmaceutical Technology, , October 1, 2010 本文作者:Michael Li,蔡月紅 Michael Li博士是榮捷生物工程(蘇州)公司工藝副總;蔡月紅是榮捷生物工程(蘇州)公司疫苗工程師。 本文來源:《制藥業》
在國際上,從提出到鼓勵普及,PAT已經歷了10余年的時間。盡管國內還處于介紹和認識階段,但是過程行業國際化特點明顯,PAT經過FDA推介,已經在具備代表性的過程行業——制藥工業中展現重要作用,這是一個很好的行業機遇。不論國內外,PAT的重要性還只是初露端倪,可以預計在下一個10年,PAT作為一個新的技術領域、一種新的理念、一種思維驅動方法,PAT將在過程行業發揮其應有作用。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..