本期看點
1. T細胞受體T細胞(TCR-T)療法IMA203在一項1b期臨床試驗中令92%轉移性黑色素瘤患者的疾病獲得控制,且患者的中位緩解持續時間(DOR)超過一年。
2. B細胞成熟抗原(BCMA)靶向自體嵌合抗原受體(CAR)-T細胞療法Ribrecabtagene autoleucel(DRL-1801)用于治療復發/難治性多發性骨髓瘤患者的1期臨床試驗結果亮眼,首批8名接受治療的患者均獲得了臨床緩解。
3. 用于治療膠質母細胞瘤(GBM)的樹突狀細胞疫苗DOC1021相比于標準治療(SOC)有望大幅延長患者的中位總生存期(OS)。
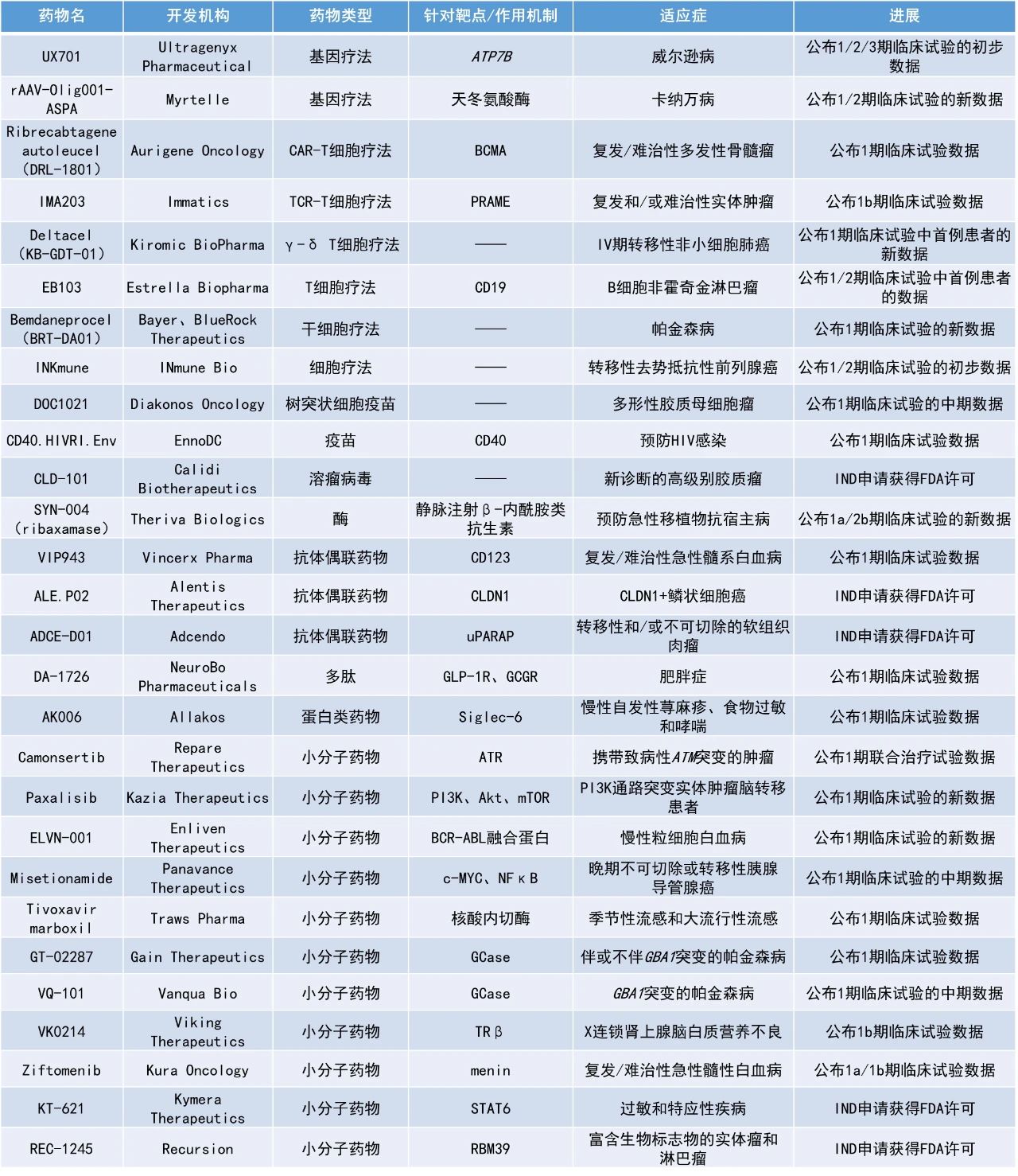
IMA203:公布1b期臨床試驗數據
Immatics公布了其在研TCR-T療法IMA203用以治療轉移性黑色素瘤患者的最新1b期臨床數據,這些患者先前接受過大量治療。IMA203是由Immatics專有的ACTengine平臺所開發的TCR-T細胞療法,靶向由HLA-A*02呈遞的黑素瘤抗原PRAME。PRAME是一種在各種實體瘤中經常表達的蛋白質,因此IMA203具潛力治療廣泛的癌癥患者群體。
此次公布的結果顯示,92%患者的疾病獲得控制且患者的中位DOR超過一年。根據此積極數據,Immatics預定在今年12月啟動SUPRAME注冊性3期試驗,預計病患招募將于2026年完成,并在2026年初進行預定的中期分析。
Ribrecabtagene autoleucel(DRL-1801):公布1期臨床試驗數據
Aurigene Oncology公司宣布其新型BCMA靶向自體CAR-T細胞療法Ribrecabtagene autoleucel(DRL-1801)用于治療復發/難治性多發性骨髓瘤的1期臨床試驗中首批8名患者的初步結果。所有患者都接受過大量的前期治療,中位治療線數為5.5線。大多數患者此前也曾接受過移植手術,并在移植后出現疾病進展。結果顯示,100%的患者獲得了臨床緩解,其中有5名(62.5%)患者獲得了嚴格的完全緩解(CR)。安全性方面,所有患者均未出現高級別的細胞因子釋放綜合征(CRS)或神經毒性。
DOC1021:公布1期臨床試驗的中期數據
Diakonos Oncology公司公布了其樹突狀細胞疫苗DOC1021用于治療膠質母細胞瘤患者的1期開放標簽試驗的中期分析結果。該公司的樹突狀細胞疫苗由患者自身的免疫細胞與從腫瘤樣本中提取的RNA和蛋白質結合制成。這種獨特的方法可以靶向完整的癌癥抗原譜,而無需進行任何基因修飾。通過利用天然的免疫信號通路,這種策略使免疫系統能將癌細胞視同受病毒感染的細胞一樣進行識別和清除。
此次公布的結果顯示,15例患有挑戰性腫瘤、MGMT未甲基化(通常預后不良)患者中有14例存活超過12個月。目前,中位隨訪時間為16個月,中位OS尚未達到。Kaplan-Meier(KM)分析將接受DOC1021治療的患者與接受完整SOC的年齡匹配歷史對照組患者進行比較,兩組在統計學上具有差異(p=0.03)。KM預測接受DOC1021治療的患者的OS為19.7個月,而接受SOC的未甲基化GBM患者的預期OS為12.7個月。安全性方面,沒有劑量限制性毒性或令人擔憂的嚴重不良事件(SAE)。
VIP943:公布1期臨床試驗數據
Vincerx Pharma公司公布了其抗體偶聯藥物(ADC)VIP943治療復發/難治性急性髓系白血病(AML)、高危骨髓增生異常綜合征(HR-MDS)和B細胞急性淋巴細胞白血病(B-ALL)的1期臨床試驗的結果。VIP943由抗CD123抗體、一種在細胞內切割的獨特連接子和一種新型驅動蛋白紡錘體蛋白抑制劑(KSPi)有效載荷組成。Vincerx的CellTrapper技術可確保KSPi有效載荷積聚在靶細胞中,限制非靶細胞、非分裂細胞的吸收,從而減少非特異性釋放。
該1期劑量遞增研究共招募了22名患者,他們很少對單一療法產生應答。9名患者(6名AML患者和3名HR-MDS患者)至少接受了3次有效劑量的VIP943治療。截至目前,1名復發性AML患者獲得了完全緩解伴血液學不完全恢復(CRi),1名HR-MDS患者獲得了完全緩解伴較少血液學恢復(CRL)。截至2024年8月的數據,VIP943顯示出良好的安全性和耐受性,沒有報告劑量限制性毒性,SAE與預期一致。
VK0214:公布1b期臨床試驗數據
Viking Therapeutics公司公布了其新型甲狀腺激素受體β(TRβ)小分子激動劑VK0214在X-連鎖腎上腺白質營養不良(X-ALD)患者中進行的1b期臨床試驗的積極數據。X-ALD是一種罕見的致命代謝性疾病,由ABCD1基因突變引起,這種突變會導致腎上腺腦白質營養不良蛋白(ALDP)功能障礙,從而引起脂肪酸的異常累積。臨床前研究表明,甲狀腺激素受體β型可以調節ABCD2相關基因的表達,ABCD2能夠編碼一種稱為腎上腺腦白質營養不良相關蛋白(ADLRP)的代償轉運體,通過增加ABCD2表達可以使特定脂肪酸水平恢復正常。
此次公布的研究結果表明,在為期28天的研究期間,VK0214每天用藥一次的安全性和耐受性良好。此外,與安慰劑相比,接受VK0214治療患者血漿中的超長鏈脂肪酸(VLCFAs)和其他血脂水平明顯降低。
Paxalisib:公布1期臨床試驗的新數據
Kazia Therapeutics公司公布其口服PI3K/mTOR雙抑制劑paxalisib聯用放射療法治療PI3K通路突變實體瘤腦轉移(BM)或軟腦膜轉移(LM)患者的1期臨床試驗的數據。此次公布的結果顯示,paxalisib聯用放療總體耐受性良好。研究中最常報告的不良反應是惡心、嘔吐和高血糖。接受45 mg paxalisib聯用放療患者中有67%獲得了部分緩解(PR),接受最大耐受劑量治療的患者中有超過三分之二的人獲得了顱內緩解,這與單獨使用全腦放療的歷史緩解率相比毫不遜色。
ELVN-001:公布1期臨床試驗的新數據
Enliven Therapeutics公司公布其小分子激酶抑制劑ELVN-001治療復發/難治性或對現有酪氨酸激酶抑制劑(TKI)不耐受的慢性髓系白血病(CML)患者的1期臨床試驗的積極數據。ELVN-001是一種強效、高選擇性、潛在“best-in-class”的小分子激酶抑制劑,專門針對CML患者的致癌驅動因子BCR-ABL融合蛋白。ELVN-001還具有針對耐藥性最強的BCR-ABL1耐藥突變體T315I和其他已知耐藥突變體的活性。
截至2024年6月25日的數據,ELVN-001的耐受性保持良好,沒有患者減少劑量,未報告≥3級治療相關的非血液學毒性反應。第24周時,患者的初始累積主要分子緩解(MMR)率為44%(8/18),與已獲批的BCR-ABL1酪氨酸激酶抑制劑在1期臨床試驗中的數據相比具有優勢。
Camonsertib:公布1期聯合治療試驗數據
Repare Therapeutics公司公布了潛在”best-in-class”口服小分子ATR抑制劑camonsertib結合姑息性放療,治療攜帶ATM突變轉移性腫瘤的1期臨床試驗數據。該試驗納入了17例攜帶ATM突變的轉移性腫瘤患者,其中12人攜帶致病性ATM基因突變,5人攜帶ATM基因突變的意義不明變異(VUS)。這些患者的原發性癌癥組織學來源包括胃腸道(n=5)、胰腺(n=5)、乳腺癌(n=2)、肺(n=2)、膀胱(n=2)和甲狀腺(n=1)。
此次公布的結果顯示,2個月時,致病性ATM突變組有2例CR、5例PR和4例疾病穩定(SD)患者,而VUS組有1例PR和4例SD患者。6個月時,在9名可評估患者中,致病性ATM突變組有2例CR、4例PR和1例SD患者,而VUS組有1例SD和1例疾病進展患者。該早期臨床數據表明camonsertib聯合放療治療有可能對攜帶致病性ATM突變的腫瘤患者進行放射增敏,從而獲得更高的臨床益處。
Misetionamide:公布1期臨床試驗的中期數據
Panavance Therapeutics公司公布了其小分子療法misetionamide(GP-2250)聯用吉西他濱治療晚期不可切除或轉移性胰腺導管腺癌患者1期臨床試驗的中期數據。Misetionamide具有獨特的作用機制,可抑制兩種致癌轉錄因子c-MYC和NFκB。此次公布的結果顯示,與單獨使用吉西他濱的歷史結果相比,接受misetionamide聯用吉西他濱治療患者的無進展生存期更長,約40%的患者達到PR或SD。此外,misetionamide聯用吉西他濱的安全性良好。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..