獲得突破性療法認定的藥物可以繼續得到加速批準或傳統完全批準;雖然 FDA 要求對獲得加速批準的藥物執行上市后研究,但對于獲得完全批準的突破性藥物通常不要求開展上市后研究,即使對于使用替代終點獲批的藥物也是如此。
研究評估了自 2012 年突破性治療認定計劃啟動至 2023 年 12 月 31 日期間支持所有 FDA 突破性治療法批準的關鍵臨床試驗中使用的主要終點。研究人員還審查了 FDA 是否要求開展額外的上市后研究以確認基于替代標志物批準的藥物的臨床療效。
FDA 越來越多地批準基于替代標志物而不是臨床結局作為主要療效終點的產品。臨床結局衡量治療效果,例如患者感受、功能或生存情況,而替代標記使用實驗室測量或影像學結果來“作為衡量臨床結局的替代量度標準。”
2013 年至 2023 年間,FDA 批準了 157 個具有突破性治療認定的產品,其中 52 個(33%)獲得加速批準,105 個(67%)獲得傳統批準。
圖1 2013 至 2023 年間獲得傳統批準的 FDA 突破性治療認定適應癥的終點(n=105)
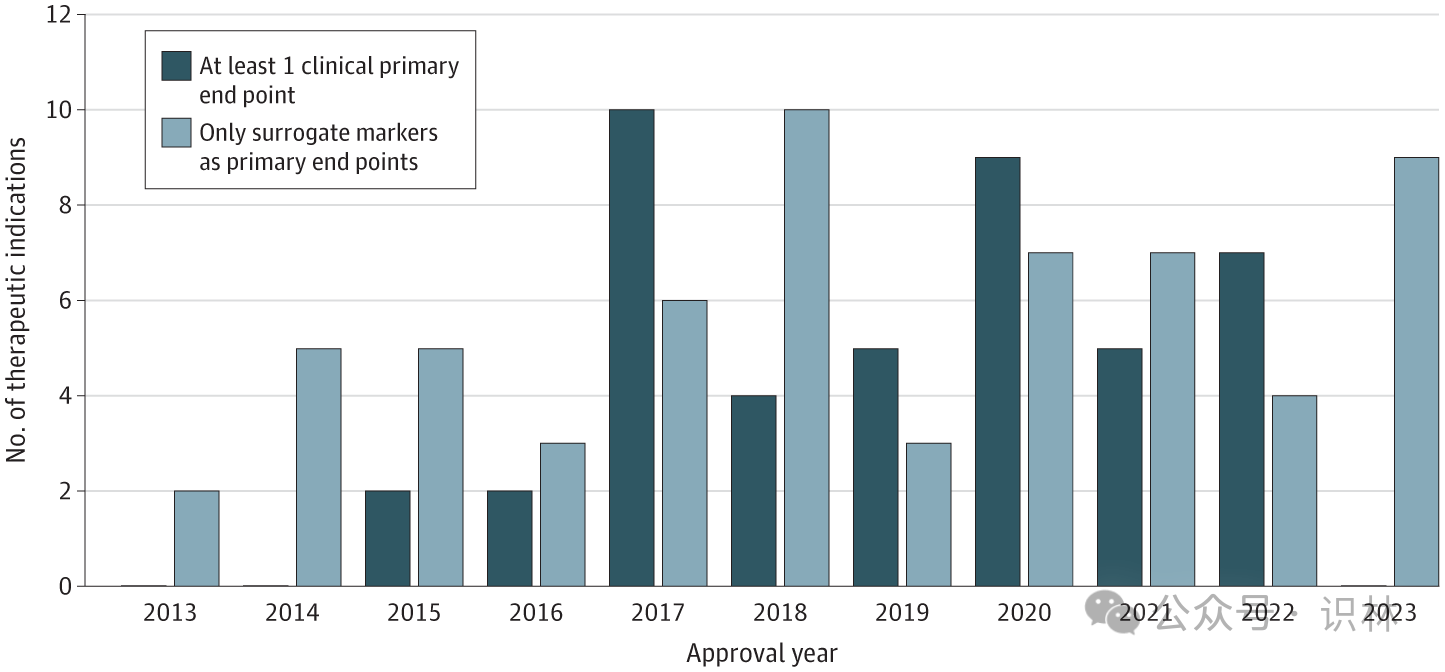
所有加速批準均基于使用替代標志物作為主要終點的關鍵試驗,FDA 要求對這些藥物進行上市后研究以確認療效。超過一半的傳統批準 (58%) 是基于依賴替代終點的關鍵試驗,其中只有 4 個 (7%) 需要完成上市后研究來確認療效。近三分之二 (64%) 獲得傳統批準的突破性藥物依賴于 FDA 認可的針對相同適應癥的替代標志物。
研究指出,“對于加速批準,FDA 要求執行上市后研究來確證所有突破性治療藥物指定適應癥的預期臨床獲益,不同的是,基于替代標志物的傳統批準通常不伴隨 FDA 對上市后療效研究的要求。”
作者得出的結論是,“有證據表明,很大一部分醫生在證據標準方面誤解了突破性治療認定的含義,包括該認定自動獲得加速審批的資格。因此,當突破性治療認定的適應癥根據替代終點而不是臨床結局獲得批準時,如果沒有統一的上市后要求來確證獲益,可能會妨礙患者和臨床醫生做出準確和明智的決策。”
[1] Mooghali M, Wallach JD, Ross JS, Ramachandran R. Premarket Pivotal Trial End Points and Postmarketing Requirements for FDA Breakthrough Therapies. JAMA Netw Open. 2024;7(8):e2430486. doi:10.1001/jamanetworkopen.2024.30486
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..